
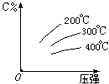
 可逆反应mA (g)+nB(s)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA (g)+nB(s)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A、达平衡后,加入催化剂,加快反应速率,使C%增大 |
| B、达平衡后,增加B的量有利于平衡向正反应方向移动 |
| C、化学方程式中m+n<e+f |
| D、该可逆反应的正反应的△H<0 |


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A、电解熔融氢氧化钠制钠,阳极发生电极反应为:4OH--4e-=O2↑+2H2O |
| B、盖?吕萨克法制钠原理是利用铁的还原性比钠强 |
| C、若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| D、目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阴极,铁为阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径 |
| B、乙醚、乙醇和苯等一些有机溶剂极易被引燃,使用时必须远离明火和热源,用毕立即塞紧瓶塞 |
| C、当吸滤瓶内液面高度快达到支管口位置时,应拔掉链接支管口的橡皮管,并从支管口倒出 |
| D、用分液漏斗进行萃取,需要几次振荡并放气,然后将分液漏斗置于铁架台的铁圈上静置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酱油 | B、纯碱 | C、食盐 | D、食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Pb(CH3COO)2+H2S═PbS↓+2CH3COOH |
| B、Pb2++H2S═PbS↓+2H+ |
| C、Pb2++2CH3COO-+H2S═PbS↓+2CH3COOH |
| D、Pb2++2CH3COO-+2H++S2-═PbS↓+2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应中某元素化合价升高,该元素一定被还原了 |
| B、金属单质在氧化还原反应中只能作还原剂 |
| C、在氧化还原反应中,非金属单质一定是氧化剂 |
| D、有气体生成的化学反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将废弃物焚烧 |
| B、将废弃物填埋于土壤中 |
| C、将废弃物倾倒在海洋中 |
| D、将废弃物加工成防水材料或汽油,变废为宝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com