
下列有关物质的性质与用途具有对应关系的是
A.SO2具有还原性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.氢 氧化铝具有弱碱性,可用作净水剂
氧化铝具有弱碱性,可用作净水剂
D.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:实验题
(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是__________mL。
(2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)________。
A. 是amL B.是(50-a)mL
C. 一定大于amL D.一定大于(50-a)mL
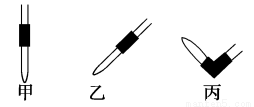
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的____________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
滴定时,1mol (CH2)6N4H+与1mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A 滴定管内液面的变化 B 锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mo1·L-1,则该样品中氮的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市西北狼教育联盟高三12月月考化学试卷(解析版) 题型:推断题
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为 ,E元素在周期表中的位置为 ,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式 。
(2)经测定A2W2为二元弱酸,A2W2的电子式为 ,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是 。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式 ,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:填空题
高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原 料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:
料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:
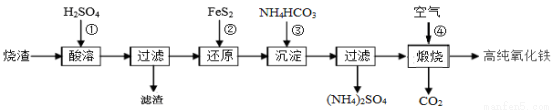
(1)酸浸时,常需将烧渣粉碎、并加入过量H2SO4,其目的是 ;
滤渣的主要成分为 (填化学式)。
(2)加入FeS2时,发生反应②的离子方程式为 。
(3)加入NH4HCO3目的是 。“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 。检验FeCO3是否洗涤干净的方法是 。
(4)煅烧时,发生反应④的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.化学反应的焓变与反应的途 径有关
径有关
B.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力减弱
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.等质量的铜按a、b两种途径完全转化为Cu(NO3)2,途径a、b消耗的硝酸一样多
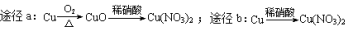
查看答案和解析>>
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)C2H2 分子中,共价键的类型有 ,C 原子的杂化轨道类型是 ,写出两个与C2H2具有相同空间构型含碳无机物分子的分子式 。
( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布为 ,Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
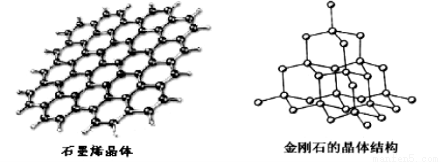
①石墨烯晶体中,每个C 原子连接 个六元环,每个六元环占有 个C 原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:选择题
下列实验操作、现象与所得结论一致的是
实验操作 | 现象 | 结论 | |
A | 向盛有25mL 沸水的烧杯中滴入5~6滴FeCl3饱和溶液,继续煮沸。 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液。 | 前者溶液变蓝,后者有黄色沉淀。 | KI3溶液中存在平衡:I3- |
C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液中。 | 酸性KMnO4溶液褪色。 | 一定产生了乙烯。 |
D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液。 | 溶液褪色。 | CaCl2溶液有酸性。 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:选择题
已知X、M都是中学教材中的常见元素,下列对两个离子反应通式的推断中,其中正确是
(甲)XO3n-+Xn-+H+→X单质+H2O(未配平)
(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A. ①③ B. ④⑤ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上周考五化学试卷(解析版) 题型:选择题
NA表示阿伏伽德罗常数的值,下列有关叙述正确的个数为
①1mol苯乙烯中含有的碳碳双键数为4NA ②4.2g乙烯和丙烯混合气中含有的极性键数目为0.6NA ③标况下,3.36LHF含有的电子数为1.5NA ④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同 ⑤高温下,16.8gFe与足量水蒸气完全反应失去0.8NA个电子 ⑥在KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应中,每生成1molCl2转移的电子总数为2NA
⑦1mol铁粉在1mol氯气中充分燃烧,转移的电子数为2NA
A. 2个 B. 3个 C. 4个 D. 5个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com