
£Ø6·Ö£©1.52gĶĆ¾ŗĻ½šĶźČ«ČܽāÓŚ50mLĆܶČĪŖ1.40g”¤mL-1”¢ÖŹĮæ·ÖŹżĪŖ63%µÄÅØĻõĖįÖŠ£¬µĆµ½NO2ŗĶN2O4µÄ»ģŗĻĘųĢå1120mL(±ź×¼×“æö)£¬Ļņ·“Ó¦ŗóµÄČÜŅŗÖŠ¼ÓČė1.0mol”¤L-1NaOHČÜŅŗ£¬µ±½šŹōĄė×ÓČ«²æ³ĮµķŹ±£¬µĆµ½2.54g³Įµķ”£
£Ø1£©øĆŗĻ½šÖŠĶÓėĆ¾µÄĪļÖŹµÄĮæÖ®±ČŹĒ ”£
£Ø2£©NO2ŗĶN2O4µÄ»ģŗĻĘųĢåÖŠ£¬NO2µÄĢå»ż·ÖŹżŹĒ ”£
£Ø3£©µĆµ½2.54 g³ĮµķŹ±£¬¼ÓČėNaOHČÜŅŗµÄĢå»żŹĒ mL”£
2:1£»80%£»640
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©½šŹōĄė×ÓČ«²æ³ĮµķŹ±£¬µĆµ½2.54g³ĮµķĪŖĒāŃõ»ÆĶ”¢ĒāŃõ»ÆĆ¾£¬¹Ź³ĮµķÖŠĒāŃõøłµÄÖŹĮæĪŖ2.54g-1.52g=1.02g£¬ĒāŃõøłµÄĪļÖŹµÄĮæĪŖ1.02g”Ā17g/mol£½0.06mol£¬øł¾ŻµēŗÉŹŲŗćæÉÖŖ£¬½šŹōĢį¹©µÄµē×ÓĪļÖŹµÄĮæµČÓŚĒāŃõøłµÄĪļÖŹµÄĮ棬ĮīĶ”¢Ć¾ŗĻ½šÖŠCu”¢MgµÄĪļÖŹµÄĮæ·Ö±šĪŖxmol”¢ymol£¬Ōņ£ŗ2x+2y£½0.06”¢64x+24y£½1.52£¬½āµĆx=0.02£¬y=0.01£¬¹ŹŗĻ½šÖŠĶÓėĆ¾µÄĪļÖŹµÄĮæÖ®±ČŹĒ0.02mol£ŗ0.01mol=2£ŗ1£»
£Ø2£©NO2ŗĶN2O4»ģŗĻĘųĢåµÄĪļÖŹµÄĮæĪŖ1.12L”Ā22.4L/mol£½0.05mol£¬Įī¶žŃõ»ÆµŖµÄĪļÖŹµÄĮæĪŖamol£¬ŌņĖÄŃõ»Æ¶žµŖµÄĪļÖŹµÄĮæĪŖ£Ø0.05-a£©mol£¬øł¾Żµē×Ó×ŖŅĘŹŲŗćæÉÖŖ£¬a”Į1+£Ø0.05-a£©”Į2”Į1=0.06£¬½āµĆa=0.04£¬ĖłŅŌNO2ŗĶN2O4µÄ»ģŗĻĘųĢåÖŠ£¬NO2µÄĢå»ż·ÖŹżŹĒ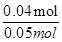 ”Į100%£½80%£»
”Į100%£½80%£»
£Ø3£©·“Ó¦ŗóČÜÖŹĪŖĻõĖįÄĘ£¬øł¾ŻµŖŌŖĖŲŹŲŗćæÉÖŖ£¬ĻõĖįÄʵÄĪļÖŹµÄĮæĪŖ0.05L”Į14mol/L-0.04mol-£Ø0.05-0.04£©”Į2=0.64mol£¬øł¾ŻÄĘĄė×ÓŹŲŗćæÉÖŖn£ØNaOH£©=n£ØNaNO3£©=0.64mol£¬¹ŹŠčŅŖĒāŃõ»ÆÄĘČÜŅŗµÄĢå»żĪŖ0.64mol”Ā1mol/L£½0.64L£½640mL”£
æ¼µć£ŗæ¼²éĆ¾ĶŗĻ½šÓėĻõĖį·“Ó¦µÄÓŠ¹Ų¼ĘĖć



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ÖĆ»»·“Ó¦µÄĶØŹ½æÉŅŌ±ķŹ¾ĪŖ£ŗ
µ„ÖŹ£Ø1£©+»ÆŗĻĪļ£Ø1£©= µ„ÖŹ£Ø2£©+»ÆŗĻĪļ£Ø2£©
ĒėĮŖĻµĖłŃ§¹żµÄµ„ÖŹ (ČēH2”¢C”¢Si”¢Cl2”¢Br2”¢I2”¢Na”¢Mg”¢Al”¢Cu”¢FeµČ)µÄŠŌÖŹ£¬Š“³öĀś×ćŅŌĻĀĢõ¼žµÄ»Æѧ·½³ĢŹ½£Øø÷Š“Ņ»øö£©”£
£Ø1£©µ„ÖŹ£Ø1£©ŗĶµ„ÖŹ£Ø2£©¶¼ŹĒ½šŹō£ŗ £»
£Ø2£©µ„ÖŹ£Ø1£©ŹĒ½šŹō£¬¶ųµ„ÖŹ£Ø2£©ŹĒ·Ē½šŹō£ŗ £»
£Ø3£©µ„ÖŹ£Ø1£©ŹĒ·Ē½šŹō£¬¶ųµ„ÖŹ£Ø2£©ŹĒ½šŹō£ŗ £»
£Ø4£©µ„ÖŹ£Ø1£©ŗĶµ„ÖŹ£Ø2£©¶¼ŹĒ·Ē½šŹō£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŃÖŖ£ŗ»¹ŌŠŌHSO”Ŗ3>I”Ŗ£¬Ńõ»ÆŠŌIO”Ŗ3>I2”£ŌŚŗ¬0.3mol NaHSO3µÄČÜŅŗÖŠÖšµĪ¼ÓČėKIO3ČÜŅŗ”£¼ÓČėKIO3ŗĶĪö³öI2µÄĪļÖŹµÄĮæµÄ¹ŲĻµĒśĻßČēÓŅĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
| A£®0”«b¼äµÄ·“Ó¦æÉÓĆČēĻĀĄė×Ó·½³ĢŹ½±ķŹ¾£ŗ3HSO3££«IO3£=3SO42££«I££«3H£« |
| B£®aµćŹ±ĻūŗÄNaHSO3µÄĪļÖŹµÄĮæĪŖ0.12mol |
| C£®µ±ČÜŅŗÖŠI”ŖÓėI2µÄĪļÖŹµÄĮæÖ®±ČĪŖ5£ŗ2Ź±£¬¼ÓČėµÄKIO3ĪŖ0.18mol |
| D£®bµćŹ±µÄ»¹Ō²śĪļæÉÄÜŹĒKI»ņNaI£¬b”«c¼äµÄ»¹Ō²śĪļŹĒI2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
³ż·ĻĘųNOµÄ·“Ó¦ŌĄķĪŖ£ŗ2CO£«2NO=N2£«2CO2ÓŠ¹ŲøĆ·“Ó¦µÄĖµ·Ø²»ÕżČ·µÄŹĒ ( )
| A£®·“Ó¦ÖŠCOĪŖŃõ»Æ¼Į |
| B£®·“Ó¦ÖŠNO±»»¹Ō |
| C£®ŌŚ·“Ӧɜ³É1 mol N2Ź±£¬×ŖŅʵĵē×ÓĪŖ4 mol |
| D£®COŗĶNO¶¼ŹĒĪŽÉ«ÓŠ¶¾ĘųĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ÓŠFe2+”¢NO-3”¢Fe3+”¢NH+4”¢H+ŗĶH2OĮłÖÖĪ¢Į££¬·Ö±šŹōÓŚĶ¬Ņ»øöŃõ»Æ»¹Ō·“Ó¦ÖŠµÄ·“Ó¦ĪļŗĶÉś³ÉĪļ£¬ĻĀĮŠŠšŹö“ķĪóµÄŹĒ£Ø £©
| A£®Ńõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ8:1 |
| B£®»¹Ō²śĪļĪŖNH+4 |
| C£®ČōÓŠl mol NO-3²Ī¼Ó»¹Ō·“Ó¦£¬Ōņ×ŖŅĘ8mol e- |
| D£®Čō°ŃøĆ·“Ó¦Éč¼ĘĪŖŌµē³Ų£¬Ōņøŗ¼«·“Ó¦ĪŖFe2+”Ŗe-=Fe3+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø10·Ö£©ĪŖĮĖ²ā¶Ø²ŻĖį¾§Ģå£ØH2C2O4”¤xH2O£©ÖŠµÄxÖµ£¬½ųŠŠČēĻĀŹµŃé
£Ø1£©³ĘČ”Wg²ŻĖį¾§Ģ壬Åä³É100.00mLČÜŅŗ
£Ø2£©Č”25.00mLĖłÅäČÜŅŗӌ׶ŠĪĘæÄŚ£¬¼ÓČėŹŹĮæĻ”H2SO4ŗó£¬ÓĆÅضČĪŖamol/LµÄKMnO4ČÜŅŗµĪ¶ØÖĮKMnO4²»ŌŁĶŹÉ«ĪŖÖ¹£¬Ėł·¢ÉśµÄ·“Ó¦ĪŖ£ŗ 2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2”ü+2MnSO4+8H2O”£
ŹŌ»Ų“š£ŗ
¢ŁŹµŃéÖŠ£¬ŠčŅŖµÄŅĒĘ÷ÓŠ£ØĢīŠņŗÅ£© £¬»¹Č±ÉŁµÄŅĒĘ÷ÓŠ£ØĢīĆū³Ę£©
AĶŠÅĢĢģĘ½£Ø“ųķĄĀė”¢Ä÷×Ó£© BµĪ¶Ø¹Ü C 100mLµÄĮæĶ² D”¢100mLµÄČŻĮæĘæ
E”¢ÉÕ± F”¢Ā©¶· G”¢×¶ŠĪĘæ H”¢²£Į§°ō I”¢Ņ©³× J”¢ÉÕĘæ
¢ŚŹµŃéÖŠ£¬±ź×¼KMnO4ČÜŅŗӦװŌŚ Ź½µĪ¶Ø¹ÜÖŠ£¬ŅņĪŖ
¢ŪČōŌŚ½Ó½üµĪ¶ØÖÕµćŹ±£¬ÓĆÉŁĮæÕōĮóĖ®½«×¶ŠĪĘæÄŚ±Ś³åĻ“Ņ»ĻĀ£¬ŌŁ¼ĢŠųµĪÖĮÖÕµć£¬ŌņĖł²āµĆµÄxµÄÖµ»į £ØĢīĘ«“ó”¢Ę«Š””¢ĪŽÓ°Ļģ£©”£
¢ÜŌŚµĪ¶Ø¹ż³ĢÖŠČōÓĆČ„amol/LµÄKMnO4ČÜŅŗVmL£¬ŌņĖłÅäÖĘµÄ²ŻĖįČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ mol/L£¬ÓÉ“Ė£¬x= ”£
¢ŻČōµĪ¶ØÖÕµć¶ĮŹżŹ±ø©ŹÓæĢ¶Č£¬Ōņ¼ĘĖćµÄxÖµ»į £ØĢīĘ«“ó”¢Ę«Š””¢ĪŽÓ°Ļģ£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
(10·Ö)ĪŖĮĖ·ĄÖ¹Ē¹Ö§ÉśŠā£¬³£½«Ē¹Ö§µÄøÖĢśĮć¼ž·ÅŌŚNaNO2ŗĶNaOHµÄ»ģŗĻŅŗÖŠ½ųŠŠ»Æѧ“¦ĄķŹ¹øÖĢśĮć¼ž±ķĆęÉś³ÉFe3O4µÄÖĀĆܵı£»¤²ć”Ŗ”Ŗ”°·¢Ą¶”±”£Ęä¹ż³ĢæÉÓĆĻĀĮŠ»Æѧ·½³ĢŹ½±ķŹ¾£ŗ ¢Ł 3Fe£«NaNO2£«5NaOH£½3Na2FeO2£«H2O£«NH3”ü
¢Ś ””Na2FeO2£«””NaNO2£«””H2O ”ś””””Na2Fe2O4£«””NH3”ü£«””NaOH
¢Ū Na2FeO2£«Na2Fe2O4£«2H2O Fe3O4£«4NaOH
Fe3O4£«4NaOH
£Ø1£©ÅäĘ½»Æѧ·½³ĢŹ½¢Ś”£
£Ø2£©ÉĻŹö·“Ó¦¢ŁÖŠ»¹Ō¼ĮĪŖ £¬ČōÓŠ1mol Na2FeO2Éś³É£¬Ōņ·“Ó¦ÖŠÓŠ”””” molµē×Ó×ŖŅĘ”£
£Ø3£©¹ŲÓŚŠĪ³É”°·¢Ą¶”±µÄ¹ż³Ģ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ”£
| A£®øĆÉś²ś¹ż³Ģ²»»į²śÉśĪŪČ¾ | B£®·“Ó¦¢ŪÉś³ÉµÄĖÄŃõ»ÆČżĢś¾ßÓŠæ¹øÆŹ“×÷ÓĆ |
| C£®·“Ó¦¢Ł¢Ś¢Ū¾łŹĒŃõ»Æ»¹Ō·“Ó¦ | D£®·“Ó¦¢Ł¢ŚÖŠµÄŃõ»Æ¼Į¾łĪŖNaNO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ć¾ŹĒŗ£Ė®ÖŠŗ¬Įæ½Ļ¶ąµÄ½šŹō£¬Ć¾”¢Ć¾ŗĻ½š¼°ĘäĆ¾µÄ»ÆŗĻĪļŌŚæĘѧъ¾æŗĶ¹¤ŅµÉś²śÖŠÓĆĶ¾·Ē³£¹ć·ŗ”£
£Ø1£©Mg2NiŹĒŅ»ÖÖ“¢ĒāŗĻ½š£¬ŅŃÖŖ£ŗ
Mg(s) + H2(g)=MgH2(s) ”÷H1=£74.5kJ”¤mol£1
Mg2Ni(s) + 2H2(g)=Mg2NiH4(s) ”÷H2=£64.4kJ”¤mol£1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) ”÷H3
Ōņ”÷H3 = kJ”¤mol£1”£
£Ø2£©¹¤ŅµÉĻæÉÓƵē½āČŪČŚµÄĪŽĖ®ĀČ»ÆĆ¾»ńµĆĆ¾”£ĘäÖŠĀČ»ÆĆ¾ĶŃĖ®ŹĒ¹Ų¼ü¹¤ŅÕÖ®Ņ»£¬Ņ»ÖÖÕżŌŚŹŌŃéµÄĀČ»ÆĆ¾¾§ĢåĶŃĖ®µÄ·½·ØŹĒ£ŗĻČ½«MgCl2”¤6H2O×Ŗ»ÆĪŖMgCl2”¤NH4Cl”¤nNH3£Øļ§Ć¾ø“ŃĪ£©,Č»ŗóŌŚ700”ęĶŃ°±µĆµ½ĪŽĖ®ĀČ»ÆĆ¾£¬ĶŃ°±·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £»µē½āČŪČŚĀČ»ÆĆ¾£¬Ņõ¼«µÄµē¼«·“Ó¦Ź½ĪŖ ”£
£Ø3£©“¢Ēā²ÄĮĻMg(AlH4)2ŌŚ110-200”ćCµÄ·“Ó¦ĪŖ£ŗMg(AlH4)2=MgH2 +2A1+3H2”üĆæÉś³É27gAl×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ ”£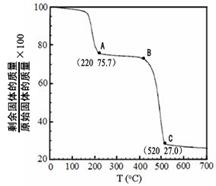
£Ø4£©¹¤ŅµÉĻÓĆMgC2O4”¤2H2OČČ·Ö½āÖĘ³¬ĻøMgO£¬ĘäČČ·Ö½āĒśĻßČēĶ¼”£
Ķ¼ÖŠøō¾ųæÕĘųĢõ¼žĻĀB”śC·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£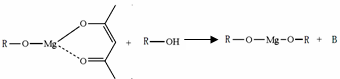
£Ø5£©Ņ»ÖÖÓŠ»śĆ¾»ÆŗĻĪļæÉÓĆÓŚÖĘŌģ¹āѧŌŖ¼žµÄĶæ²¼Ņŗ£¬»ÆѧŹ½æɱķŹ¾ĪŖ£ŗ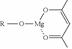 £¬ĖüæÉ·¢ÉśČēĻĀ·“Ó¦£ŗ
£¬ĖüæÉ·¢ÉśČēĻĀ·“Ó¦£ŗ
ROHÓėBµÄŗĖ“Ź²ÕńĒāĘ×ČēĻĀĶ¼: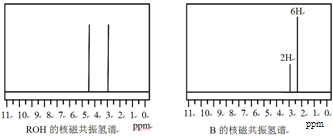
ROHÓÉC”¢H”¢O”¢FĖÄÖÖŌŖĖŲ×é³ÉµÄŗ¬·śÓŠ»śĪļ£¬·Ö×ÓÖŠÖ»ÓŠ1øöŃõŌ×Ó£¬ĖłÓŠ·śŌ×Ó»Æѧ»·¾³ĻąĶ¬£¬Ļą¶Ō·Ö×ÓÖŹĮæĪŖ168£¬ŌņROHµÄ½į¹¹¼ņŹ½ĪŖ £» BµÄ½į¹¹¼ņŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
A”¢B”¢C”¢D”¢FŹĒ³£¼ūµÄ»ÆŗĻĪļ£¬ĘäÖŠFŌŚ³£ĪĀĻĀŹĒŅ»ÖÖĪŽÉ«ŅŗĢ壬DĪŖĒæĖį£¬Ēėøł¾ŻĻĀĶ¼×Ŗ»Æ¹ŲĻµ£Ø·“Ó¦Ģõ¼ž¼°²æ·Ö²śĪļŅŃĀŌČ„£©£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ČōA”¢B”¢C”¢D¾łĪŖŗ¬ĮņŌŖĖŲµÄ»ÆŗĻĪļ£¬AŹĒŅ»ÖÖ³£¼ūµÄæóŹÆµÄÖ÷ŅŖ³É·Ö£¬ĒŅAµÄĦ¶ūÖŹĮæĪŖ120 ”£ ·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ £»
”£ ·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ £»
£Ø2£©ČōA”¢B”¢C”¢D¾łĪŖŗ¬µŖŌŖĖŲµÄ»ÆŗĻĪļ£¬ĒŅAµÄŅ»øö·Ö×ÓÖŠÖ»ŗ¬ÓŠ10øöµē×Ó£¬Ōņ£ŗ
¢ŁA·Ö×ÓŹ½ĪŖ__________£»
¢Ś·“Ó¦¢ÜµÄĄė×Ó·½³ĢŹ½ĪŖ________________________________________________
¢ŪČ”CuŗĶCu2OµÄ»ģŗĻĪļѳʷ12£®0g£¬¼ÓČėµ½×ćĮæµÄDµÄĻ”ČÜŅŗÖŠ£¬ÓĆÅÅĖ®·ØŹÕ¼Æ²śÉśµÄĘųĢ壬±ź×¼×“æöĻĀĘäĢå»żĪŖ2£®24L£¬Ōņѳʷ֊Cu2OµÄÖŹĮæĪŖ__________g”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com