8.甲醇的研究成为当代社会的热点.
Ⅰ.甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
(1)101kPa时,1mol CH
3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为CH
3OH(l)+$\frac{3}{2}$O
2(g)=CO
2(g)+2H
2O(l)△H=-725.76kJ•mol
-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH
3OH(g)+H
2O(g)═CO
2(g)+3H
2(g)△H
1=+49.0kJ•mol
-1②CH
3OH(g)+$\frac{1}{2}$O
2(g)═CO
2(g)+2H
2(g)△H
2已知H
2(g)+$\frac{1}{2}$O
2(g)═H
2O(g)△H=-241.8kJ•mol
-1,则反应②的△H
2=-192.8kJ•mol
-1.
(3)甲醇燃料电池的结构示意图如图1.甲醇进入负极(填“正”或“负”),正极发生的电极反应为O
2+4H
++4e
-═2H
2O.
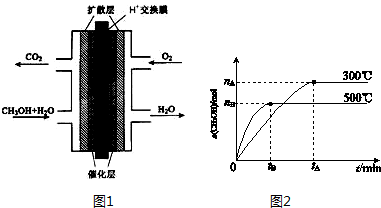
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H
2(g)?CH
3OH(g)达到化学平衡状态.
(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;根据图2,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(2)500℃时,从反应开始到达到化学平衡,以H
2的浓度变化表示的化学反应速率是$\frac{2{n}_{B}}{3{t}_{B}}$(用n
B、t
B表示).
(3)判断该可逆反应达到化学平衡状态的标志是c、d(填字母).
a.v
生成(CH
3OH)=v
消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H
2、CH
3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是c、d(填字母).
a.c(H
2)减少 b.正反应速率加快,逆反应速率减慢
c.CH
3OH 的物质的量增加 d.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量•
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量•
