
分析 (1)甲烷燃料电池中,负极上投放燃料甲烷,发生失电子发生氧化反应,正极上投放氧气,发生得电子的还原反应;
(2)利用盖斯定律解答,从待求反应出发分析反应物、生成物在所给反应中的位置,通过相互加减可得.
解答 解:(1)在碱性溶液中,负极上投放燃料甲烷,发生失电子发生氧化反应:CH4-8e-+10OH-═CO32-+7H2O,正极上投放氧气,发生得电子的还原反应:2O2+4H2O+8e-═8OH-,燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,生成水,溶液体积增大,pH减小,
故答案为:CH4-8e-+10OH-═CO32-+7H2O,O2+4e-+2H2O=4OH-;降低;
(2)据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1.
点评 本题考查较为综合,涉及原电池以及盖斯定律等知识,为高频考点,侧重于学生的分析、计算能力的考查,注意把握原电池的工作原理以及电极方程式的书写,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A. | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B. | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验SO42- |
| C. | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D. | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- I- |
| A. | 由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+ | |
| B. | Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O | |
| C. | 原溶液一定只含有的离子I-、NO3-、SO42-、Mg2+、Al3+ | |
| D. | 另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 50 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
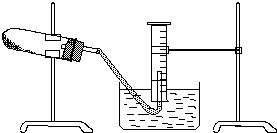 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com