
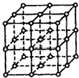
 如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.
如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.分析 (1)氯化钠晶体中钠离子、氯离子的配位数都是6;
(2)在NaCl晶胞中,Na+或Cl-所处的位置是顶点面心和棱边的中点,钠离子、氯离子的配位数都是6,所以与Na+最接近的且距离相等的Na+共有12个;
(3)根据NaCl的摩尔质量及密度求得晶胞的体积,进而求得棱边长,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半.
解答 解:(1)氯化钠晶体中,钠离子或氯离子的配位数都是6,氯化钠晶体的结构示意图为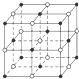 ,故答案为:
,故答案为: ;
;
(2)在NaCl晶胞中,Na+或Cl-所处的位置是顶点面心和棱边的中点,钠离子、氯离子的配位数都是6,所以与Na+最接近的且距离相等的Na+共有12个,故答案为:12;
(3)设晶胞边长为a,在NaCl晶胞中,含Cl-4个;含Na4个,根据密度公式$ρ=\frac{m}{V}=\frac{\frac{4×58.5}{6.02×1{0}^{23}}}{{a}^{3}}$,可得a=$\root{3}{\frac{4×58.5}{2.2×6.02×1{0}^{23}}}$,所以晶胞面对角线长为$\sqrt{2}$a,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的钠离子中心间的距离为4.0×10-8cm,故答案为:4.0×10-8.
点评 本题主要考查了晶胞的结构和晶胞的计算,难度不大,解题的关键要充分用好立体几何的知识,发挥空间想象力,解决问题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
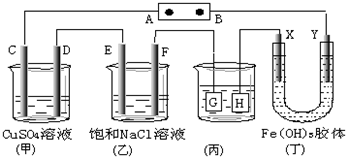
| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 氨水 | C. | AgNO3 溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H+(aq)+OH- (aq)═H2O(l);△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)═H2O(l)△H=-44.0kJ•mol-1可知是放热反应 | |
| C. | 由SO2(g)+0.5O2(g)═SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 由△G=△H-T△S可知,所有放热反应都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
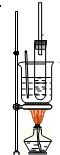 实验室制取硝基苯的方法如图所示:
实验室制取硝基苯的方法如图所示: ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
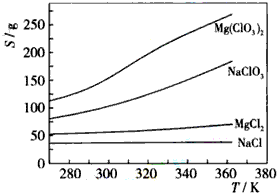 (1)下列有关硅单质及其化合物的说法正确的是B.
(1)下列有关硅单质及其化合物的说法正确的是B.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
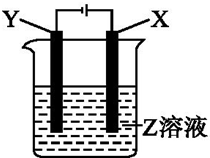 根据如图所示装置回答:
根据如图所示装置回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 验证氯气能否与水反应的实验时,用氢氧化钠溶液处理尾气 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com