
下列叙述I和叙述II均正确且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4可以发生 |
| C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列排列顺序不正确的是
A.热稳定性:HF>HCl>HBr B.原子半径:Na>S>O
C.离子半径: Mg2+>O2->F- D.酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列各组溶液中,加水稀释时c(OH-)/c(H+)的值明显增大,且能大量共存的离子组是 ( )。
①K+、Al3+、NO3-、AlO2- ②K+、Fe2+、I-、SO42- ③K+、I-、NO3-、
Na+ ④Na+、Ca2+、Al3+、Cl-
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
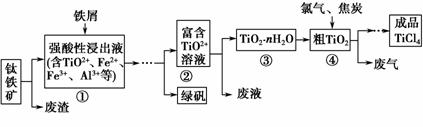
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe===3Fe2+
2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O===TiO2+(无色)+Fe2++2H+
加入铁屑的作用是_________________________________________________。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在________范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=________。
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g)
ΔH=+140 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭 、氯气反应生成液态TiCl4和CO气体的热化学方程式:______________________________________
、氯气反应生成液态TiCl4和CO气体的热化学方程式:______________________________________ ___________________________。
___________________________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是________(只要求写出一项)。 (6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
颜六色的颜色变化增添了化学的魅力,对下列有关反应的颜色叙述正确的是
①新制氯水久置后→浅黄绿色消失; ②淀粉溶液遇碘单质→蓝色;
③氯化铁溶液滴入甲苯中→紫色; ④热的黑色氧化铜遇乙醇→红色
A.①③④ B.①②④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
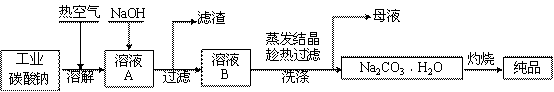 |
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
 Na2CO3·10H2O Na2CO3·7H2O Na2CO3·H2O
Na2CO3·10H2O Na2CO3·7H2O Na2CO3·H2O
32 36 t(℃)
回答下列问题:
(1)溶解时通入热空气的作用有 (写出两条即可);生成氢氧化镁沉淀的离子方程式为 。
(2)“趁热过滤”时的温度应控制在 ;简述过滤后洗涤固体的操作 。
(3)为检验母液中是否含有Cl-,必须加入的试剂为 。
(4)实验室进行“灼烧”的陶瓷仪器有 。
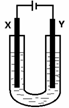 (5)室温下用石墨电极电解饱和Na2CO3溶液(装置如图),写出Y电极
(5)室温下用石墨电极电解饱和Na2CO3溶液(装置如图),写出Y电极
反应式: ;一段时间后X电极可收集到的
气体一定有 ,可能有 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象所对应的离子方程式不正确的是 ( )。
| 选项 | 实验 | 现象 | 离子方程式 |
| A | 将稀硫酸滴加到KI淀粉溶液中 | 在空气中放置一段时间后溶液呈蓝色 | 4H++4I-+O2===2I2+2H2O |
| B | 用硫氰化钾溶液检验某溶液中含有Fe3+ | 溶液变成红色 | Fe3++3SCN-=== Fe(SCN)3 |
| C |
| 溶液紫色褪去 | 2MnO4-+5SO32-+6H+ ===2Mn2++5SO42-+3H2O |
| D | 将稀硫酸滴加到含有酚酞的Ba(OH)2溶液中 | 有白色沉淀生成,溶液由红色变成无色 | Ba2++OH-+H++SO42- ===BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知33As、35Br位于同一周期。某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是___ _____。
_____。
(3)在该反应条件下可推知________(填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为________,其中1 mol KBrO3得到电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入少许CC l4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
l4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式____________________________________________ ____________________。
____________________。
(2)整个过程中的还原剂是________。
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_________________________________________________________________。
(4)加碘盐中含碘量为20~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,保留2位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com