
【题目】氧化锌为白色固体,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
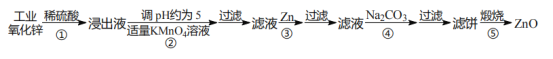
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是 MnO2。回答下列问题:
(1)为加快步骤①的浸取速率,下列措施中无法达到目的是_____(填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌
d.适当增加硫酸浓度 e.适当升高温度
(2)反应②中除掉的杂质离子是_____(填离子符号),发生反应的离子方程式为:_____。
(3)加入高锰酸钾溶液前,若 pH 较低,对除杂的影响是_____。
(4)步骤③过滤得到的滤渣中,除了过量的锌外还有_____。
(5)反应④中产物的成分可能是 ZnCO3xZn(OH)2。取干燥后的滤饼 11.2 g,煅烧后可得到产品 8.1 g,则 x=_____(ZnCO3、Zn(OH)2 的相对分子质量分别为:125、99)。
【答案】b ![]() 、
、![]()
![]() 、
、![]() 若pH较低,
若pH较低,![]() 的氧化性增强,还原产物就不是
的氧化性增强,还原产物就不是![]() 沉淀而是
沉淀而是![]() ,同时也不利于
,同时也不利于![]() 沉淀的生成 镍 1
沉淀的生成 镍 1
【解析】
本题是一道无机化学工业流程题,首先明确我们的目标是纯化工业级氧化锌,因此第一步先加稀硫酸溶解,浸出液中加适量![]() 可以将
可以将![]() 氧化成
氧化成![]() 并通过调节pH转化为
并通过调节pH转化为![]() 沉淀,同时+7价锰和+2价锰发生归中反应产生
沉淀,同时+7价锰和+2价锰发生归中反应产生![]() 沉淀,接着过滤除去
沉淀,接着过滤除去![]() 和
和![]() 。 加入锌粒还原溶液中剩余的镍离子,再过滤除去单质镍和过量的锌粒,加入碳酸钠得到碳酸锌沉淀,过滤后煅烧碳酸锌分解产生氧化锌,本题得解。
。 加入锌粒还原溶液中剩余的镍离子,再过滤除去单质镍和过量的锌粒,加入碳酸钠得到碳酸锌沉淀,过滤后煅烧碳酸锌分解产生氧化锌,本题得解。
(1)a.将样品粉碎可以增大接触面积,加快反应进行,a项正确;
b.延长浸取时间无法加快浸取速率,只能增大浸出率,b项错误;
c.充分搅拌本质上可以起到增大接触面积的作用,因此也可以加快反应速率,c项正确;
d.适当增加硫酸浓度相当于增大了反应物浓度,正反应速率加快,d项正确;
e.适当升高温度也可以增大反应速率,e项正确;
答案选b;
(2)根据分析反应②中除掉的是![]() 和
和![]() ,因此写出对应的反应方程式即可,分别为:
,因此写出对应的反应方程式即可,分别为:![]() 和
和![]() ;
;
(3)若溶液pH较低,首先![]() 的氧化性增强,还原产物就不是
的氧化性增强,还原产物就不是![]() 沉淀而是
沉淀而是![]() ,引入了新的杂质,其次也不利于
,引入了新的杂质,其次也不利于![]() 沉淀的生成;
沉淀的生成;
(4)根据分析还有单质镍;
(5)一个自然的想法就是列二元一次方程来求解,设滤饼中有![]() 共x mol,
共x mol,![]() 共y mol,首先根据质量关系有:
共y mol,首先根据质量关系有:![]() ,又因为二者的分解产物均为
,又因为二者的分解产物均为![]() ,煅烧后的8.1g其实就是
,煅烧后的8.1g其实就是![]() 的
的![]() ,也就是说锌一共有0.1mol,因此根据物质的量关系有
,也就是说锌一共有0.1mol,因此根据物质的量关系有![]() ,联立两个方程解出
,联立两个方程解出![]() 、
、![]() ,也就是说
,也就是说![]() 和
和![]() 的物质的量为1:1,化学式中的x自然为1。
的物质的量为1:1,化学式中的x自然为1。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对H2(g)+I2(g)![]() 2HI(g)的反应类型判断错误的是( )
2HI(g)的反应类型判断错误的是( )
A.放出能量的反应B.吸收能量的反应
C.氧化还原反应D.可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:

下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子。
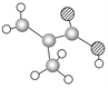
该物质的结构简式为__,该物质中所含官能团的名称为__。
(2)下列各组物质:①O2和O3②H2、D2、T2③12C和14C④CH3CH2CH2CH3和(CH3)2CH2CH3⑤乙烷和丁烷⑥CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5互为同系物的是__,互为同分异构体的是__,互为同位素的是__,互为同素异形体的是__,是同一物质的是__。
(3)酚酞是常用的酸碱指示剂,其结构简式如图所示:
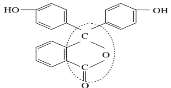
①酚酞的分子式为__。
②从结构上分析酚酞可看作__。
A.烯烃 B.芳香化合物 C.醇类物质 D.酚类物质 E.醚类物质 F.酯类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

已知E是形成酸雨的主要气体,请回答:
(1)A的组成元素为______(用化学符号表示);
(2)C溶液可溶解铜片,写出该反应的离子方程式______________________________;
(3)写出F→G反应的化学方程式_________________________________,设计实验证明溶液G中含有![]() ____________________________________________________________________。
____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1905年哈珀开发实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈珀也因此获得了1918年的诺贝尔化学奖。
(1)工业合成氨的反应如下:N2+3H2 2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成2 mol NH3 的能量变化为__________kJ。 下图能正确表示该反应中能量变化的是__________(填“A”或“B”)。
2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成2 mol NH3 的能量变化为__________kJ。 下图能正确表示该反应中能量变化的是__________(填“A”或“B”)。
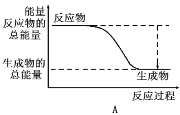
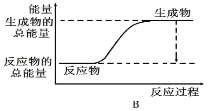
(2)反应2NH3(g)![]() N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据回答:实验①②中,有一个实验使用了催化剂,它是实验_____(填序号);实验①③对比说明了_________________________________。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_________(填序号)。
a. NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
(3)近日美国犹他大学 Minteer教授成功构筑了H2—N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则A电极为_____极(填“正”、“负”),该电池放电时溶液中的H+向______极移动(填“A”、“B”)。
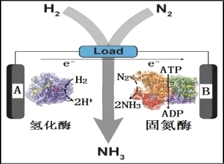
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,
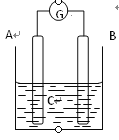
下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
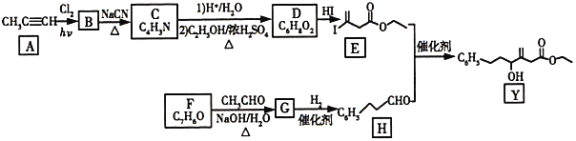
已知:RCHO+CH3CHO![]() RCH=CHCH3+H2O
RCH=CHCH3+H2O
回答下列问题:
(1)A的化学名称是__________;状态__________。
(2)B为单氯代烃,分子式为C3H3Cl,由B生成C的反应类型 __________。
(3)A中少一个碳原子的有机物结构简式__________;实验室制备该气体化学方程式__________ 。
(4)E的分子式为__________。
(5)Y中含氧官能团的名称为__________。
(6)X与H互为同分异构体,写出一种符合条件的X的结构简式__________。
①具有完全相同官能团; ②苯环上有2个取代基;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com