
| A. | H2SO4与 Ba(OH)2 溶液反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 金属钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 向足量NaHCO3溶液中滴人少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 常温下,将氯气通人水中:Cl2+H2O═2H++2Cl-+ClO- |
分析 A.氢离子、氢氧根离子的计量数错误;
B.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒;
C.氢氧化钙少量,离子方程式按照氢氧化钙的化学式组成书写;
D.次氯酸为弱酸,离子方程式中次氯酸不能拆开.
解答 解:A.H2SO4与 Ba(OH)2 溶液反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O,故A错误;
B.金属钠与水的反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.向足量NaHCO3溶液中滴人少量Ca(OH)2溶液,反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-,故C正确;
D.常温下,将氯气通人水中,次氯酸不能拆开,正确的离子方程式为:Cl2+H2O═H++2Cl-+HClO,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内2a mol A生成,同时生成a mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | 混合气体的总压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汤姆生--提出带核的原子结构模型 | |
| B. | 维勒--合成尿素实现了无机物向有机物的转化 | |
| C. | 玻尔--根据ɑ粒子散射现象提出原子结构的量子力学模型 | |
| D. | 侯德榜--侯氏制碱法的原理是将氨气通入二氧化碳的氯化钠饱和溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
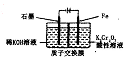 电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )| A. | 阳极反应为Fe-2e-=Fe2+ | |
| B. | 在阴极室,发生的电极反应为:Cr2O72-+6e-+7H2O=Cr(OH)3+8OH- | |
| C. | 在阳极室,pH增大会有Fe(OH)3沉淀生成 | |
| D. | 电路中每转移12 mol电子,最多有1 mol Cr2O72- 被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
| 实验编号 | 起始浓度/mol/L | 反应后溶液的pH | |
| c (HA) | c (NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 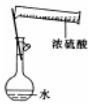 配制一定物质的量浓度的稀硫酸 | B. | 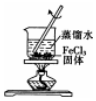 制取少量的Fe(OH)3胶体 | ||
| C. | 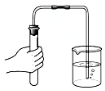 检查气密性 | D. | 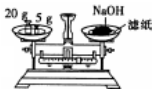 称量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z<W | |
| D. | 还原性Z m->W(m+1)-,氧化性Xn+>Y(n+1)+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com