
| A. | $\frac{a(A-N+3)}{A+3}$mol | B. | $\frac{a(A-N+8)}{A+16}$mol | ||
| C. | $\frac{a(2A-2N+40)}{2A+90}$mol | D. | $\frac{2A-2N+24}{2A+54}$mol |
分析 它的气态氢化物为XH3,则它与18O形成的最高价气态氧化物为X2O5,所以氧化物的摩尔质量为:(2A+90)g/mol,则ag氧化物的物质的量为:$\frac{ag}{(2A+90)g/mol}$=$\frac{a}{2A+90}$mol,所以ag中含有质子的物质的量为$\frac{a}{2A+90}$×[2(A-N)+5×8]mol,由此解答.
解答 解:它的气态氢化物为XH3,则它与18O形成的最高价气态氧化物为X2O5,所以氧化物的摩尔质量为:(2A+90)g/mol,所以ag氧化物的物质的量为:$\frac{ag}{(2A+90)g/mol}$=$\frac{a}{2A+90}$mol,所以ag中含有质子的物质的量为$\frac{a}{2A+90}$×[2(A-N)+5×8]mol=$\frac{a(2A-2N+40)}{2A+90}$mol,
故选:C.
点评 本题考查了物质的量计算原子的构成,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握原子中质量数、质子数和中子数的关系.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑧ | B. | ④⑤⑦⑧ | C. | ③④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
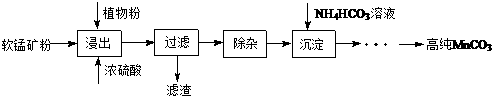
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冬季居民的家中用煤取暖 | B. | 城市和乡村大力开展植树造林 | ||
| C. | 工厂排放烟尘的烟囱加高 | D. | 将城市的固体废弃物运向农村倾倒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH(CH2)2CH3 | B. | CH2=CH(CH2)3CH3 | ||
| C. | CH3CH=CHCH=CHCH3 | D. | CH3CH2CH=CHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
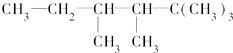
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥⅠA族元素的氢化物中,稳定性最好的沸点也最高 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com