C
分析:A、铁在氯气中燃烧生成氯化铁,根据方程式计算过量判断,根据不足的物质计算转移电子数.
B、随反应进行浓硫酸变为稀硫酸,稀硫酸不与铜反应.
C、Na
2S和Na
2O
2的摩尔质量都是78g/mol,7.8g 混合物的物质的量为0.1mol,硫化钠是由钠离子与硫离子构成,过氧化钠由钠离子与过氧根离子构成,每摩尔Na
2S和Na
2O
2都含1mol阴离子.
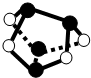
D、As原子半径比S原子半径大,由结构可知,黑色球为As,白色球为S,分子中不存在S-S键.
解答:A、5.6g铁粉的物质的量为0.1mol,铁在氯气中燃烧生成氯化铁,反应方程式为2Fe+3Cl
2=2FeCl
3,所以氯气的物质的量不足,根据氯气计算转移电子数,氯元素化合价由0价降低为-1价,所以转移电子数为0.1mol×2×N
Amol
-1=0.2N
A,
故A错误;
B、发生反应Cu+2H
2SO
4(浓)=CuSO
4+SO
2↑+2H
2O12.5mL 16mol?L
-1,由方程式可知其氧化剂的硫酸占

,12.5mL16mol?L
-1浓硫酸中硫酸完全反应,转移电子数为0.0125L×16mol?L
-1×

×2×N
Amol
-1=0.2N
A,随反应进行浓硫酸变为稀硫酸,稀硫酸不与铜反应,所以转移电子数小于0.2N
A,故B错误;
C、Na
2S和Na
2O
2的摩尔质量都是78g/mol,7.8g 混合物的物质的量为0.1mol,硫化钠是由钠离子与硫离子构成,过氧化钠由钠离子与过氧根离子构成,每摩尔Na
2S和Na
2O
2都含1mol阴离子,所以7.8g Na
2S和Na
2O
2的混合物中含有的阴离子为0.1mol,阴离子数等于0.1N
A,故C正确;
D、黑色球为As,白色球为S,分子中不存在S-S键,故D错误.
故选:C.
点评:考查常用化学计量计算、晶体结构、氧化还原反应、浓度与物质性质关系等,浓度中等,注意A中铁过量与否都生成氯化铁,与铁通硝酸的反应不同.

 NA表示阿伏加德罗常数的值,下列说法正确的是
NA表示阿伏加德罗常数的值,下列说法正确的是 ,12.5mL16mol?L-1浓硫酸中硫酸完全反应,转移电子数为0.0125L×16mol?L-1×
,12.5mL16mol?L-1浓硫酸中硫酸完全反应,转移电子数为0.0125L×16mol?L-1× ×2×NAmol-1=0.2NA,随反应进行浓硫酸变为稀硫酸,稀硫酸不与铜反应,所以转移电子数小于0.2NA,故B错误;
×2×NAmol-1=0.2NA,随反应进行浓硫酸变为稀硫酸,稀硫酸不与铜反应,所以转移电子数小于0.2NA,故B错误;

 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案