
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.甲醇 B.天然气
C.液化石油气 D.氢气
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管2,再测试管2中有机层的厚度,实验记录如下:
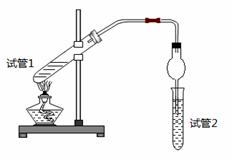
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
(1)写出实验A中试管1反应的化学方程式________________________________。
(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol/L。
(3)分析实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 ___ 。
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH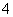 、Cl-、Mg2+、Ba2+、CO
、Cl-、Mg2+、Ba2+、CO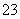 、SO
、SO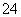 ,现取三份100 mL溶液进行如下实验:
,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生。
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是( )
A.K+不一定存在
B.100 mL溶液中含0.01 mol CO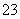
C.Cl-可能存在
D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氢氧燃料电池以KOH溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将________,溶液的pH____________________________。(填“减小”、“增大”或“不变”)
(2)氢氧燃料电池以H2SO4溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将________,溶液的pH________。(填“减小”、“增大”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:
Ni(OH)2+M===NiOOH+MH
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO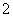
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成的原电池,负极反应式为Al-3e-===Al3+
B.由Mg、Al、NaOH溶液组成的原电池,负极反应式为Al-3e-+4OH-===AlO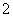 +2H2O
+2H2O
C.由Fe、Cu、FeCl3溶液组成的原电池,负极反应式为Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成的原电池,负极反应式为Cu-2e-===Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp (25℃)如下:
| AgCl | AgI | Ag2S | |
| Ksp(单位省略) | 1.8×10-10 | 1.5×10-16 | 6.3×10-50 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀容易转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
通常状况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关 叙述正确的是( )
叙述正确的是( )
A.NCl3分 子中N—Cl键的键长比CCl4分子中C—Cl键的键长长
子中N—Cl键的键长比CCl4分子中C—Cl键的键长长
B.NCl3分子是非极性分子
C.分子中的所 有原子均达到8电子稳定结构
有原子均达到8电子稳定结构
D.NBr3比NCl3易挥发
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com