
| A. | HCO3- | B. | SO${\;}_{4}^{2-}$ | C. | NH${\;}_{4}^{+}$ | D. | Fe2+ |
分析 Na2O2具有强氧化性,与水反应后溶液呈碱性,具有还原性的离子和能与OH-反应的离子浓度发生改变,据此进行解答.
解答 解:A.Na2O2与水反应后溶液呈碱性,HCO3-与OH-反应,HCO3-离子浓度减小,故A错误;
B.Na2O2与水反应后溶液呈碱性,SO42-不与OH-反应,离子浓度未发生明显变化,故B正确;
C.Na2O2与水反应后溶液呈碱性,铵根离子与OH-反应,离子浓度发生明显变化,故C错误;
D、Na2O2具有强氧化性,将Fe2+氧化成Fe2+,Fe2+离子浓度变小,故D错误;
故选B.
点评 本题考查过氧化钠的性质、离子反应发生条件及其应用,题目难度不大,明确过氧化钠的性质为解答关键,注意掌握离子反应发生条件,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 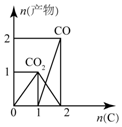 图:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物 | |
| B. | 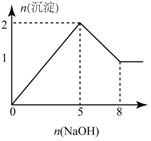 图:向含有1molMgCl2和1molAlCl3混合溶液中滴加NaOH,产生沉淀物质的量 | |
| C. | 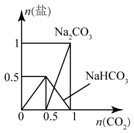 图:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| D. | 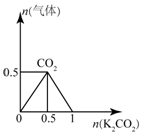 图:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敲口容器中生成的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| B. | 7.8gNa2O2固体中含有的阴离子数为0.2NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.l mol Cl2参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
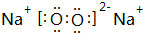 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).
如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{23}$mol | B. | $\frac{a(b+1)}{23}$mol | C. | $\frac{18ab}{23}$g | D. | $\frac{18a(b+1)}{23}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
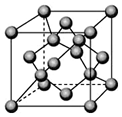 已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:
已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
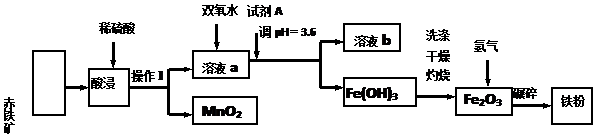
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe (OH)2 | Cu (OH)2 |
| pH | 3.4 | 5.2 | 9.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com