
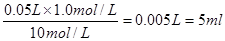 。
。

 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源:不详 题型:单选题
| A.量筒、水 | B.容量瓶、四氯化碳 |
| C.量筒、苯 | D.容量瓶、水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用酸式滴定管量取20.0mL酸性高锰酸钾溶液; |
| B.用米汤直接检验食盐中是否有碘元素; |
| C.用酚酞检验纯碱中是否含有烧碱; |
| D.多次盐析或多次渗析的方法分离提纯蛋白质; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
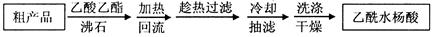
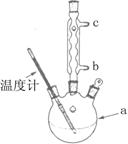
| A.称取0.300 g样品。 |
| B.将样品与25 mL 4 mol·L-lNaOH溶液在三颈烧瓶中混合,水浴加热回流l小时后停止加热(发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+ NaCl)。 |
| C.在三颈烧瓶中加入50 mL 2 mol·L-l HNO3,混合均匀。 |
| D.将三颈烧瓶中溶液全部转移到100 mL容量瓶中,加水定容。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.用托盘天平准确称取所需的Na2CO3固体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
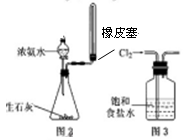
| A.用水湿润pH试纸测量某溶液的pH |
| B.用量筒量取20mol ?L-1H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol·L-1H2SO4溶液 |
| C.实验室用图2所示装置制取少量氨气 |
| D.实验室用图3所示装置出去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
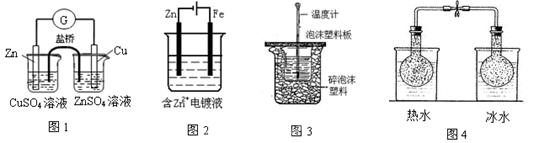
| A.用图1所示装置组成锌铜原电池 |
| B.用图2所示装置在铁棒上镀锌 |
| C.用图3所示装置测定稀硫酸和稀NaOH反应的中和热 |
D.用图4所示装置研究温度对2NO2(g) N2O4(g)平衡的影响 N2O4(g)平衡的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com