
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作时,下列说法正确的是

A.盐桥中Cl-向Y极移动
B.电路中流过7.5 mol电子时,共产生标准状况下N2的体积为16.8L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH—,周围pH增大
【答案】D
【解析】
根据处理垃圾渗滤液并用其发电的示意图可知,装置属于原电池装置,X是负极,发生失电子的氧化反应,Y是正极,发生得电子的还原反应![]() ,电解质里的阳离子移向正极,阴离子移向负极,电子从负极流向正极。
,电解质里的阳离子移向正极,阴离子移向负极,电子从负极流向正极。
A. 处理垃圾渗滤液的装置属于原电池装置,溶液中的阴离子移向负极,即氯离子向X 极移动,故A错误;
B. 电池总反应为:![]() ,该反应转移了15个电子,即转移15个电子生成4个氮气,故电路中流过7.5 mol电子时,产生2mol氮气,即44.8L,B错误;
,该反应转移了15个电子,即转移15个电子生成4个氮气,故电路中流过7.5 mol电子时,产生2mol氮气,即44.8L,B错误;
C. 电流由正极流向负极,即Y极沿导线流向X 极,故C错误;
D. Y是正极,发生得电子的还原反应,![]() ,周围pH 增大,故D正确;
,周围pH 增大,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是( )

A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3-的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U型物称量,质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:
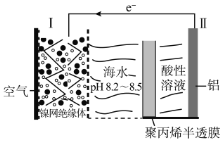
下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为:O2+4H++4e-=2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极II为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4g时,正极消耗3.36L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池是一种新型电池,其能量密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉。已知锂硫电池的总反应为![]() ,用此电池作电源电解足量的
,用此电池作电源电解足量的![]() 溶液,其工作原理如图所示。下列有关说法正确的是( )
溶液,其工作原理如图所示。下列有关说法正确的是( )

A.乙池溶液中的NO3![]() 移向铁电极
移向铁电极
B.乙池石墨电极反应式为![]()
C.甲池充电时,锂电极发生氧化反应
D.甲池中消耗14g锂,乙池中产生![]() 氧气
氧气![]() 标准状况下
标准状况下![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为2K2S2+KI3![]() K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是![]() ( )
( )
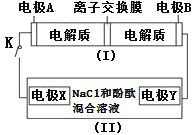
A.闭合K时,K+从左到右通过离子交换膜
B.闭合K时,电极X是阳极
C.闭合K时,电极A的反应式为3I--2e-=I3-
D.闭合K时,当有0.1molK+通过离子交换膜,X电极上产生气体2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将0.5mol/L的氨水逐滴加入10.00mL0.5mol/L盐酸中,溶液中温度变化曲线Ⅰ、pH变化曲线Ⅱ与加入氨水的体积的关系如图所示(忽略混合时溶液体积的变化)。下列说法正确的是( )

A.Kw的比较:a点比b点大
B.b点氨水与盐酸恰好完全反应,且溶液中c(NH4+)=c(Cl-)
C.c点时溶液中c(NH4+)=c(Cl-)=c(OH-)=c(H+)
D.d点时溶液中c(NH3H2O)+2c(OH-)=c(NH4+)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的装置,判断下列说法正确的是( )
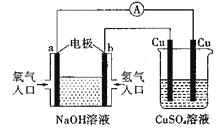
A.该装置中a极为负极
B.当装置中某一块铜片的质量变化了12.8g时,a极上消耗O2在标准状况下的体积为4.48L
C.该装置中b极的电极反应式是:H2-2e-=2H+
D.一段时间后,左边装置中溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是

A. 常温下Kb(NH3·H2O)> Kal(H2CO3)
B. 向pH =6.5的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3一浓度都逐渐减小
C. NH4HCO3溶液中存在下列守恒关系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO3 2-)+c( H2 CO3)
D. 当溶液的pH =9时,溶液中存在下列关系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO3 2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com