
【题目】已知:2H2(g)+O2(g)═2H2O(l) △H= -571.6kJmol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H= -1452kJmol-1
H+(aq)+OH-(aq)═H2O(l) △H= -57.3kJmol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6kJmol-1
B.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H=-57.3kJmol-1
BaSO4(s)+H2O(l) △H=-57.3kJmol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)═CH3OH(l)+H2O(l) △H=+131.4kJmol-1
【答案】C
【解析】
A.燃烧热为1mol可燃物燃烧放热,H2(g)的燃烧热为285.8kJmol-1,故A错误;
B.SO42-(aq)+Ba2+(aq)═BaSO4(s)△H<0,![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H<-57.3kJmol-1,故B错误;
BaSO4(s)+H2O(l) △H<-57.3kJmol-1,故B错误;
C.1g氢气放热![]() ,1g甲醇放热
,1g甲醇放热![]() ,所以同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多,故C正确;
,所以同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多,故C正确;
D.2H2(g)+O2(g)═2H2O(l) △H= -571.6kJmol-1①;2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H= -1452kJmol-1②;根据盖斯定律①![]() -②
-②![]() ,3H2(g)+CO2(g)═CH3OH(l)+H2O(l) △H=-131.4kJmol-1,故D错误。
,3H2(g)+CO2(g)═CH3OH(l)+H2O(l) △H=-131.4kJmol-1,故D错误。
答案选C。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+ ![]() O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是

A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) +![]() O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①C(s)+O2(g)![]() CO2(g) ΔH=-393.5kJ/mol
CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g)![]() 2H2O(1) ΔH=-571.6kJ/mol
2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
A.1︰1 B.1︰2 C.2︰3 D.3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列不能用勒夏特列原理解释的是( )
A.H2、I2、HI混合气体加压后颜色变深
B.合成氨时将氨液化分离,可提高原料的利用率
C.向氯水中缓慢加入硝酸银固体,氯水颜色变浅
D.使用MnO2作催化剂能加速H2O2的分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)苹果酸(![]() )常用于汽水、糖果的添加剂。
)常用于汽水、糖果的添加剂。
(1)写出苹果酸中官能团的名称___________________
(2)写出苹果酸分别与下列物质反应的化学方程式①Na_______________
②Na2CO3______________________________
(3)写出其一分子内酯化成四元环酯的结构简式:_______________。
(II)(4)如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子)按下列要求,回答问题:

①用系统命名法命名________。
②M的一氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应A(g)2B(g)△H,若正反应的活化能为EakJ·mol-l,逆反应的活化能为EbkJ·mol-l,则△H=-(Ea-Eb)kJ·mol-l
B.某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液溶质的质量分数为20%
C.将0.2mol·L-1的CH3COOH溶液与0.1mol·L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示:
2SO3(g),反应过程的能量变化如图所示:
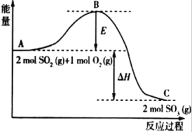
已知2mol SO2(g)和O2(g)反应生成为1mol SO3(g)的ΔΗ=-99kJ·mol-1,请回答下列问题。
(1)该反应通常用V2O5作催化剂,加V2O5会使图中B点_______ (填“升高”或“降低”)。
(2)图中ΔΗ= __________。
(3)如果反应速率v(SO2)为0.05mol·L-1·min-1,则v(O2)= _______。
Ⅱ.已知下列热化学方程式:
①H2O(l)===H2(g)+![]() O2(g)ΔH=+285.8 kJ/mol
O2(g)ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g)ΔH=-241.8 kJ/mol
O2(g)===H2O(g)ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于吸热反应的是___________;
(2)燃烧10 g H2生成液态水,放出的热量为__________;
(3)写出CO燃烧的热化学方程式__________;
(4)写出制水煤气的热化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是廉价的碳资源,其综合利用具有重要意义。
(1)CO2与CH4经催化重整反应CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+120kJ·mol-1可以制得合成气。
已知上述反应中相关物质所含化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | a | b | c | x |
①x=___。
②分别在恒温密闭容器A(恒容)、B(恒压,体积可变)中,加入CH4和CO2各1mol的混合气体,起始体积均为VL。相同温度下两容器中反应达平衡后吸收热量较多的是___ (填“A”或“B”)。保持A容器的体积和B容器压强不变,写出一种能使A、B两容器中各物质的体积分数相同的方法:___。
③某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行反应,达到平衡时CO2的体积分数为![]() ,该温度下反应的平衡常数为___。
,该温度下反应的平衡常数为___。
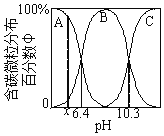
(2)CO2可以被NaOH捕获。所得溶液中含碳微粒的分布百分数随pH的变化如图所示。H2CO3的二级电离平衡常数Ka2=___。pH=5.4时,φ(A):φ(B)=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com