
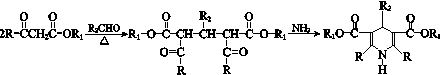
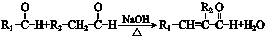 (R、R1、R2表示氢原子或烃基)
(R、R1、R2表示氢原子或烃基) .
.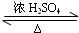 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.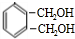 +O2 $→_{△}^{催化剂}$
+O2 $→_{△}^{催化剂}$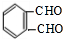 +2H2O.
+2H2O.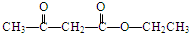 .
.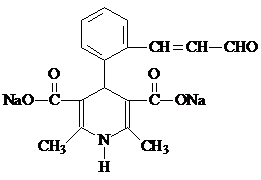 .
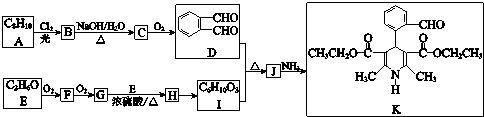
. 分析 结合A的分子式与D的结构,可知A为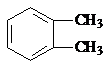
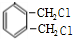 ,C为
,C为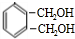 .E可以连续发生氧化反应,结合E的分子式可知E为C2H5OH,则F为CH3CHO,G为CH3COOH,H为CH3COOC2H5,I与C反应得到J,J与氨气反应得到K,由K的结构逆推结合信息,可知J为
.E可以连续发生氧化反应,结合E的分子式可知E为C2H5OH,则F为CH3CHO,G为CH3COOH,H为CH3COOC2H5,I与C反应得到J,J与氨气反应得到K,由K的结构逆推结合信息,可知J为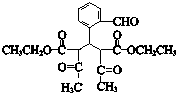 ,I为
,I为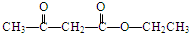 .
.
解答 解:结合A的分子式与D的结构,可知A为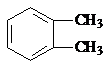
 ,C为
,C为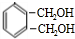 .E可以连续发生氧化反应,结合E的分子式可知E为C2H5OH,则F为CH3CHO,G为CH3COOH,H为CH3COOC2H5,I与C反应得到J,J与氨气反应得到K,由K的结构逆推结合信息,可知J为
.E可以连续发生氧化反应,结合E的分子式可知E为C2H5OH,则F为CH3CHO,G为CH3COOH,H为CH3COOC2H5,I与C反应得到J,J与氨气反应得到K,由K的结构逆推结合信息,可知J为 ,I为
,I为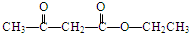 .
.
(1)A的结构简式是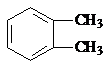
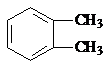
(2)B→C的反应类型是取代反应,故答案为:取代反应;
(3)F为CH3CHO,含有的官能团是醛基,故答案为:醛基;
(4)G与E生成H的化学方程式是:CH3COOH+C2H5OH 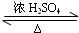 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH 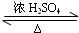 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(5)C→D的化学方程式是: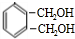 +O2 $→_{△}^{催化剂}$
+O2 $→_{△}^{催化剂}$ +2H2O,
+2H2O,
故答案为: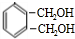 +O2 $→_{△}^{催化剂}$
+O2 $→_{△}^{催化剂}$ +2H2O;
+2H2O;
(6)I的结构简式是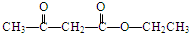 ,
,
故答案为: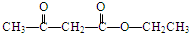 ;
;
(7)J为 ,
,
a.没有羧基,不能与NaHCO3反应,故a错误;
b.含有酯基,能与NaOH反应,故b正确;
c.含有醛基,能与新制Cu(OH)2反应,故c正确,
故选:bc;
(8)K存在以下转化关系:K$→_{NaOH/△}^{CH_{3}CHO}$M(C16H15NO5Na2),发生信息Ⅱ中反应及酯碱性条件下水解反应,则M的结构简式是
故答案为:
点评 本题考查有机物的推断越合成,正确理解题给信息是解本题关键,采用正推的方法进行分析解答,侧重考查学生的分析推理能力、知识迁移运用能力,难度中等.


科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
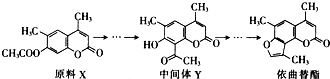
| A. | X与Y互为同分异构体 | |
| B. | X与Y均不能使酸性KMnO4溶液褪色 | |
| C. | 在光照条件下,依曲替酯中的苯环能与Cl2发生取代反应 | |
| D. | 依曲替酯中所有不饱和键均能与溴发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | ①滴加稀HNO3 ②滴加BaCl2溶液 | 无明显现象 白色沉淀 | 原溶液一定含SO${\;}_{4}^{2-}$ |
| B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含CO${\;}_{3}^{2-}$ |
| C | ①滴加稀HCl ②滴加AgNO3溶液 | 无明显现象 白色沉淀 | 原溶液一定含Cl- |
| D | ①滴加KCSN溶液 ②滴加氯水 | 无明显现象 溶液呈红色 | 原溶液一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与CO2反应生成Na2CO3 Na2O2+CO2═Na2CO3+O2 | |
| B. | Na2CO3溶液呈碱性 CO32-+H2O?H2CO3+OH- | |
| C. | Na2CO3溶液除去CH3COOC2H5中的CH3COOH CO32-+2H+═CO2↑+H2O | |
| D. | 饱和Na2CO3溶液处理水垢中的CaSO4 CO32-+CaSO4═CaCO3+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| C. | Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
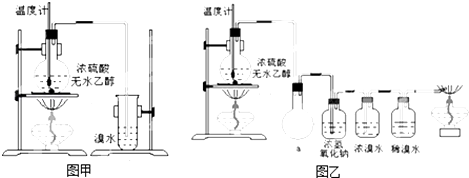
 CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br.
CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com