
分析 (1)根据c=$\frac{1000ρω}{M}$计算该浓盐酸的物质的量浓度;根据V=$\frac{n}{c}$进行计算;
(2)①电解含氧酸盐时,阴极上氢离子放电生成氢气;
②测得溶液的pH为13,所以氢氧根离子的浓度为:0.1mol/L,则氢氧根离子的物质的量为:0.1mol/L×0.5L=0.05mol,即氢氧化钠和物质的量为:0.05mol,由此求体积;
(3)根据原子利用率的公式计算其利用率;
(4)将方程式书写为由氯化钠生成二氧化氯的反应方程式,再利用原子利用率进行计算.
解答 解:(1)c=$\frac{1000ρω}{M}$=$\frac{1.1593×1000×32%}{36.5}$=10.16 mol/L,若要制取1mol ClO2,需要2mol的盐酸,V=$\frac{n}{c}$=$\frac{2}{10.16}$=0.19685L=196.85mL,
故答案为:10.16; 196.85;
(2)①电解含氧酸盐时,阴极上氢离子放电生成氢气,所以电极反应式为:2H++2e-=H2↑,而阳极是ClO2-放电生成ClO2↑,总的化学方程式为:2NaClO2+2H2$\frac{\underline{\;通电\;}}{\;}$2 ClO2↑+2NaOH+H2↑,
故答案为:2NaClO2+2H2$\frac{\underline{\;通电\;}}{\;}$2 ClO2↑+2NaOH+H2↑;
②测得溶液的pH为13,所以氢氧根离子的浓度为:0.1mol/L,则氢氧根离子的物质的量为:0.1mol/L×0.5L=0.05mol,即氢氧化钠和物质的量为:0.05mol,所以体积为:1.12L,
故答案为:氢氧根离子的物质的量为:0.1mol/L×0.5L=0.05mol,即氢氧化钠和物质的量为:0.05mol,而n(ClO2)=n(NaOH),所以体积为:0.05mol×22.4L/mol=1.12L;
(3)假设生成2mol二氧化氯,则需要亚氯酸钠的物质的量是2mol,Cl2的物质的量是1mol,
m(ClO2)=2mol×67.5g/mol=135g,m(NaClO2)=2mol×90.5g/mol=181g,m(Cl2)=1mol×71g/mol=
71g,原子利用率=$\frac{135g}{181g+71g}$×100%=53.57%,
故答案为:m(ClO2)=2mol×67.5g/mol=135g,m(NaClO2)=2mol×90.5g/mol=181g,m(Cl2)=1mol×71g/mol=
71g,原子利用率=$\frac{135g}{181g+71g}$×100%=53.57%;
(4)①NaCl+3H2O $\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑,
②H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,
③2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O
将方程式2①+2②+③得4H2O+Cl2=4H2+2ClO2↑,
设生成的二氧化氯的物质的量是2mol,参加反应的水的物质的量是4mol,参加反应的氯气的物质的量是2mol,m(ClO2)=2mol×67.5g/mol=135g,m(H2O)=4mol×18g/mol=72g,m(Cl2)=1mol×71g/mol=71g,
则原子利用率=$\frac{135g}{71g+72g}$×100%=94.4%,
故答案为:94.4%.
点评 本题考查了化学方程式的有关计算,根据原子利用率的概念来进行计算即可,易错点是(3),根据提供公式是解答题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C3H4和C2H6 | B. | C2H2和C6H6 | C. | C3H6O和C3H8O2 | D. | C3H8O和C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)═2H2O(g)△H=-482.6kJ•mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)═3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
| A. | 571.6 kJ•mol-1,2221.5kJ•mol-1 | B. | 241.3 kJ•mol-1,2013.8 kJ•mol-1 | ||
| C. | 285.8 kJ•mol-1,2013.8 kJ•mol-1 | D. | 285.8 kJ•mol-1,2221.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
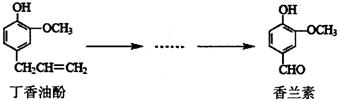 香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )| A. | 在丁香油酚分子中至少有12个原子共平面 | |
| B. | 常温下,1mol丁香油酚可与2molBr2反应 | |
| C. | 1moI香兰素最多能与4mol氢气发生加成反应 | |
| D. | 可用酸性KMnO4溶液检验丁香油酚中是否含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

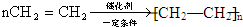 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 和CH3CH2CH2Br的方法如图1.
和CH3CH2CH2Br的方法如图1.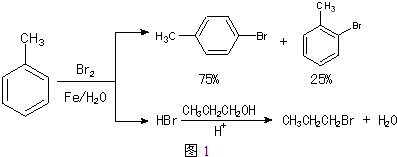
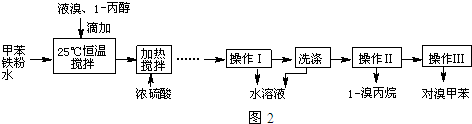
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
| 沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
 .
.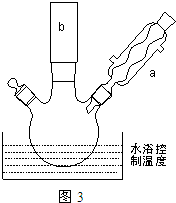 ①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.
①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O | B. | C2H4O | C. | C2H6 | D. | C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与X形成的化合物溶于水后溶液呈碱性 | |
| B. | 简单离子半径:W<X<Z | |
| C. | 气态氢化物的热稳定性:W<Y | |
| D. | 最高价氧化物的水化物的酸性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Cl-、I- | B. | K+、NO3-、Mg2+、SO42- | ||
| C. | Na+、Cu2+、Cl-、SO42- | D. | Na+、K+、HCO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com