
右图所示装置中,a、b、c、d、e、f均为惰性电极,电解质溶液均足量。接通电源后,d极附近显红色。下列说法正确的是
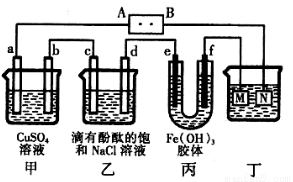
A.电源B端是正极
B.a、c电极均有单质生成,其物质的量之比为2:1
C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液
D.f极附近变红,说明氢氧化铁胶粒带正电荷
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:填空题
【化学与技术】
以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如下: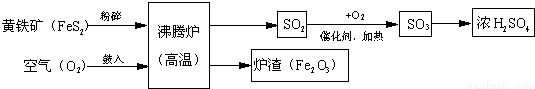
(1)写出流程图中一种氧化物的名称 。
(2)将黄铁矿粉碎,目的是 。
(3)流程中SO2转化为SO3的化学方程式为 。
(4)炉渣(Fe2O3)在工业上可用来 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:推断题
【化学与技术】
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
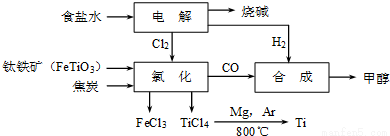
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图____。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)氯碱厂获得Cl2的离子方程式为 。
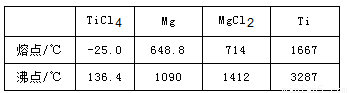
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:推断题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
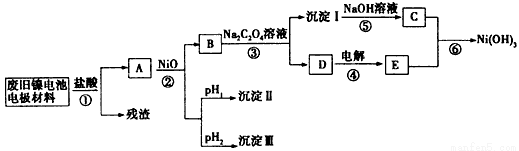
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:

回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是 。第③步反应后,过滤沉淀时需要的玻璃仪器有 。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.4.0 g重水(D2O)中所含中子数为1.6 NA
B.1 L 2 mol·L-1 K2S溶液中S2-和HS-的总数为2 NA
C. 2.4g金刚石与石墨的混合物中所含碳原子数为0.2 NA
D.50 mL 18 mol·L-1浓硫酸与足量铜反应,转移的电子数为0.9 NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列叙述正确的是
A.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区
B.电解精炼铜时,反应开始一段时间内阳极溶解铜的质量比阴极析出铜的质量大
C.海轮外壳上镶入锌块,可减缓船体的腐蚀
D.在铁片上镀铜时,若铁片增重3.2g,则电路中通过的电子的物质的量为0.05mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子.
请回答下列问题:
(1)G基态原子的核外电子排布式是 ;
(2)C、D、E的第一电离能由大到小的顺序是:
(3)下列有关上述元素的说法中,不正确的是 (填字母)
a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含 个σ键。
(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为 ;
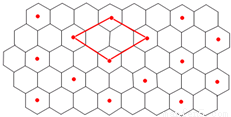
(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“?”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:简答题
无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3,还含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2===4AlCl3+3O2
回答以下问题:
(1)Cl-的电子式为 ________。Al在元素周期表最中的位置是________。
(2)生产中加入石油焦,其目的是_____________________________________。
(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2 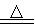 AlCl3+X↑,设计实验确定气体X的成分:
AlCl3+X↑,设计实验确定气体X的成分:
____________________________________________________________。
(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为 _____________________________________________________________。
(5)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①过程涉及的离子方程式__________________________、___________。
②AlCl3产品的纯度为__________________________________。
(6)以铝土矿为原料可以通过以下途径提纯氧化铝

①写出滤液甲中溶质的化学式______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
相同状况下,在容积相同的三个烧瓶内分别充满干燥的NH3、HCl、NO2气体,做喷泉实验,所得三种溶液的物质的量浓度比为( )
A.3∶3∶2 B.2∶2∶3
C.1∶1∶1 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com