
| A. | 8 | B. | 9 | C. | 11 | D. | 12 |
分析 设电离的弱碱MOH浓度为x,
则:MOH?OH-+M+
初始 0.1 0 0
反应 x x x
平衡 0.1-x x x
所以 K=$\frac{{x}^{2}}{0.1-x}$=1.0×10-3,
由于x很小,所以 0.1-x≈0.1,即x2=1.0×10-3×0.1,x=1.0×10-2mol/L,由此分析解答.
解答 设电离的弱碱MOH浓度为x,
则:MOH?OH-+M+
初始 0.1 0 0
反应 x x x
平衡 0.1-x x x
所以 K=$\frac{{x}^{2}}{0.1-x}$=1.0×10-3,
由于x很小,所以 0.1-x≈0.1,即x2=1.0×10-3×0.1,x=1.0×10-2mol/L,
所以pOH=2,则pH=14-2=12,
故选D.
点评 本题考查了弱电解质的电离,根据电离平衡常数公式来分析解答,为易错点,其中学生要清楚弱电解质的电离也是极其微弱的.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入Ca(OH)2溶液,有白色沉淀生成,则溶液中一定存在CO32- | |
| B. | 加入Ba(NO3)2 溶液,生成白色沉淀,加入稀盐酸后沉淀不溶解时,可确定有SO42-存在 | |
| C. | 加入CCl4,振荡,静置,下层溶液呈紫色,则原溶液中存在碘单质 | |
| D. | 加入AgNO3溶液,生成白色沉淀,加入稀盐酸沉淀不溶解时,可确定有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若提供0.4 mol HCl,MnO2过量,则可制得氯气4.48 L | |
| B. | 若提供0.4 mol HCl,MnO2过量,则转移电子数一定为0.1mol | |
| C. | 若有0.4 mol HCl参加反应,则可制得氯气2.24 L | |
| D. | 若有0.4 mol HCl被氧化,则可制得氯气2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
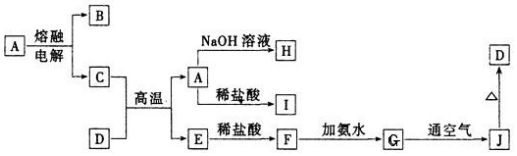
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的CH4在反应①、②中转移的电子数不相同 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol | |
| C. | 4NO2(g)+2N2(g)═8NO(g);△H=+586kJ/mol | |
| D. | 若用2.24LCH4把NO2还原为N2,整个过程中转移的电子总数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温,0.1mol•L-1的CH3COOH溶液中:c(CH3COOH)<c(CH3COO-) | |
| B. | 1L 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中:c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | 室温,0.1mol•L-1的CH3COONa、NaOH和Na2CO3三种溶液,pH大小的顺序为:NaOH<CH3COONa<Na2CO3 | |
| D. | 向0.01mol•L-1的NaHSO4溶液中滴加NaOH溶液至中性时:c(SO${\;}_{4}^{2-}$)>c(Na+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作过程 | 实验现象描述 | 对应离子方程式或化学方程式 |
| FeCl2中通入Cl2 | 溶液变黄 | 2Fe2++Cl2=2Fe3+ |
| Fe(OH)2放置空气 | 白色沉淀迅速变为灰绿色,最终变为红褐色 | 4Fe(OH)2+O2+4H2O=4Fe(OH)3 |
| KI溶液中通入氯气,加入CCl4后震荡 | 溶液变为棕色,加入四氯化碳后分层,且四氯化碳层显紫色 | Cl2+2I-=2Cl-+I2 |
| 盐酸溶液中缓慢滴加Na[Al(OH)4]溶液至过量 | 先无沉淀,后生成白色沉淀 | [Al(OH)4]-+4H+=Al3++4H2O,3[Al(OH)4]-+Al3+=4Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
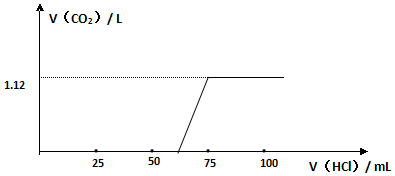
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com