
| A. | c(H+)<c(OH-)的溶液一定显碱性 | B. | pH=6的溶液一定显酸性 | ||
| C. | pH=7的溶液一定显中性 | D. | Kw只适用于纯水 |
分析 A.溶液的酸碱性取决于溶液中氢离子浓度和氢氧根离子浓度的相对大小;
B.100℃时,pH=6的溶液显中性;
C.不是在常温下,pH=7的溶液不一定为中性;
D.水的离子积与溶液的酸碱性无关.
解答 解:A.溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,当溶液中氢氧根离子浓度大于氢离子浓度时,溶液呈碱性,故A正确;
B.常温下,水的离子积Kw=1×10-14,所以pH<7,溶液呈酸性,100℃时,水的离子积常数是10-12,当pH=6时溶液呈中性,所以pH=6的溶液不一定显酸性,故B错误;
C.溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小,当c(H+)=c(OH-),溶液呈中性.常温下,水的离子积Kw=1×10-14,所以pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性.Kw受温度影响,水的电离是吸热的,温度越高Kw越大,如100℃时,水的离子积常数是10-12,当pH=6时溶液呈中性,此时pH=7时溶液呈碱性,该选项中pH=7的溶液,不一定是在常温下,溶液中c(H+)、c(OH-)不一定相等,故C错误;
D.水的离子积适用于酸性、中性和碱性溶液,故D错误;
故选A.
点评 本题考查了溶液酸碱性的判断方法,题目难度中等,解题关键是抓住溶液呈酸碱性是氢离子和氢氧根离子的相对大小,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| D. | 滴定过程中不小心将液体从锥形瓶溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯胺处理自来水:NH2Cl+H2O?NH2OH+HCl | |
| B. | 在含有Mg2+、HCO3-的自来水中加入过量的澄清石灰水:Ca2++Mg2++2OH-+2HCO3-═CaCO3↓+MgCO3↓+2H2O | |
| C. | 长时间煮沸含Mg2+、HCO3-的自来水:Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑ | |
| D. | Na2FeO4既是混凝剂、又可作消毒剂,作混凝剂的作用原理为:Fe3++3H2O═Fe(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>H2S | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 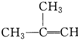 -CH3+Br2→ -CH3+Br2→ | |
| B. | CH2=CH-CH3+HCl→ | |
| C. | CH2=CH-CH=CH2+Br2→ | |
| D. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
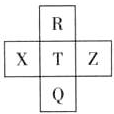 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 单质的沸点:T>Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:T<Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com