
为解决能源危机,在汽油中掺入一定比例的乙醇(即“乙醇汽油”),以代替一部分汽油.乙醇在气缸中完全燃烧的热化学方程式为: C2H5OH(l)+
C2H5OH(l)+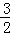 O2(g)=CO2(g)+
O2(g)=CO2(g)+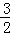 H2O(l)△H1=﹣683.4kJ/mol.下列说法正确的是( )
H2O(l)△H1=﹣683.4kJ/mol.下列说法正确的是( )
|
| A. | 该反应过程中,断裂化学键会放出热量 |
|
| B. | 该反应中,生成物的总能量大于反应物的总能量 |
|
| C. | 乙醇的燃烧热为683.4 kJ/mol |
|
| D. | 反应 |
| 反应热和焓变;热化学方程式. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | A、反应过程中断裂化学键吸收热量; B、反应是放热反应,反应物总能量大于生成物总能量; C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量; D、反应从液态水生成气态水时,需要吸收能量,反应焓变大于﹣683.4kJ/mol; |
| 解答: | 解:A、反应过程中断裂化学键吸收热量;故A错误; B、反应是放热反应,反应物总能量大于生成物总能量;故B错误; C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;热化学方程式中可燃物不是1mol,故C错误; D、反应从液态水生成气态水时,需要吸收能量,反应焓变大于﹣683.4kJ/mol;故D正确; 故选D. |
| 点评: | 本题考查了反应能量变化和化学键的变化关系,燃烧热的概念判断,盖斯定律的应用,题目难度中等. |


科目:高中化学 来源: 题型:
下列各组物质熔化或汽化时所克服的微粒间的作用力属同种类型的是( )
A.石英和生石灰的熔化 B.晶体硅和晶体硫的熔化
C.钠和铁的熔化 D.碘和氯化铵的汽化
查看答案和解析>>
科目:高中化学 来源: 题型:
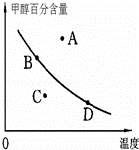
已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式 .
(2)该反应的正反应是 反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度/(mol•L﹣1) | 0.54 | 0.68 | 0.68 |
①此时系统温度400℃,比较正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中 点.比较图中B、D两点所对应的正反应速率B D(填“>”、“<”或“=”).理由是 .
(4)一定条件下要提高反应物的转化率,可以采用的措施是
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特利原理来解释的是( )
|
| A. | 用排饱和食盐水的方法收集氯气 |
|
| B. | 合成氨工业选择高温 |
|
| C. | 增大压强,有利于SO2和O2反应生成SO3 |
|
| D. | 在Fe3++3SCN ﹣⇌Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应 SO2(g)+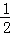 O2(g)⇌SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
O2(g)⇌SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
|
| A. | 等于0.3mol | B. | 等于0.15mol |
|
| C. | 小于0.15mol | D. | 大于0.15mol,小于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
在﹣50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)⇌N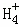 +N
+N ,N
,N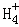 的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
|
| A. | 在液氨中加入NaNH2,可使液氨的离子积变大 |
|
| B. | 在液氨中加入NH4Cl,液氨的离子积不变 |
|
| C. | 此温度下液氨的离子积K为1×10﹣30 |
|
| D. | 在液氨中加入金属钠可能有NaNH2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
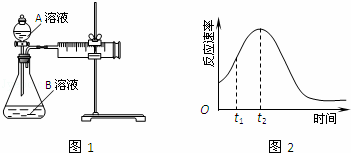
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1和表(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
(1)写出草酸溶于水的电离方程式: .
(2)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:① ②(填:>、<、=).
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(5)小组同学发现反应速率总是如2图,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、② .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其Ksp=cm(An+)·cn(Bm-),称为难溶电解质的溶度积。25 ℃时,向AgCl的白色悬浊液中依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知所有的物质的颜色和溶度积如下表:
| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25 ℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25 ℃时,饱和AgCl、AgI、Ag2S溶液中Ag+的浓度相同
D.25 ℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NH3分子可与Cu2+形成配合物离子2+,则除去硫酸铜溶液中少量硫酸可选用的试剂是( )
A.NaOH B.NH3·H2O
C.CuO D.BaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com