
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
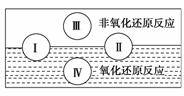
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
________________________________________________________________________其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl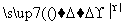
Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________ (填元素名称),氧化剂是________(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10,
10C+P4O10===P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
mol P4时,就有________mol电子发生转移。
解析 (1)由图可知,反应类型Ⅳ全部属于氧化还原反应,应该是置换反应,有水参加的置换反应有许多,如C+H2O(g)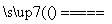 CO+H2、2Na+2H2O===2NaOH+H2↑等上述两个反应中水均作氧化剂。
CO+H2、2Na+2H2O===2NaOH+H2↑等上述两个反应中水均作氧化剂。
(2)①用化合价升降法配平化学方程式为4CuO+2NH4Cl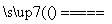 3Cu+CuCl2+N2↑+4H2O。
3Cu+CuCl2+N2↑+4H2O。
②在该反应中,氮元素化合价升高,被氧化,NH 4Cl为还原剂,铜元素化合价降低,被还原,CuO为氧化剂。
4Cl为还原剂,铜元素化合价降低,被还原,CuO为氧化剂。
(3)反应过程中磷酸钙最终变成了白磷,磷的化合价由+5价 变成0价,由此可以得到如下关系式:
变成0价,由此可以得到如下关系式:
2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20  mol电子。
mol电子。
答案 (1)C+H2O(g)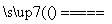 CO+H2(合理即可) 氧化
CO+H2(合理即可) 氧化
(2) ①4CuO+2NH4Cl
①4CuO+2NH4Cl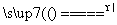 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
②氮 CuO (3)20


科目:高中化学 来源: 题型:
研究NO2、SO2.CO等大气污染气体的处理具有重要意义。
(1) NO2可用水吸收,相应的化学反应方程式为__________ ___ 利用反应6 NO2+8NH3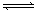 7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2,在标准状况下是_____________L。
7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2,在标准状况下是_____________L。
(2)已知:2SO2(g)+O2(g) 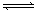 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
2NO(g)+O2(g)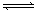 2NO2(g) △H=-113.0 kJ·mol -1
2NO2(g) △H=-113.0 kJ·mol -1
则反应NO2(g)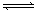 SO2(g)+ NO2的△H=________ kJ·mol -1 一定条件下,将NO2与SO2以体积比之于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________
SO2(g)+ NO2的△H=________ kJ·mol -1 一定条件下,将NO2与SO2以体积比之于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO2 测得
上述反应平衡是NO2与SO2体积比为1:6则平衡比常数k=________
| |
| |
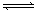 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。 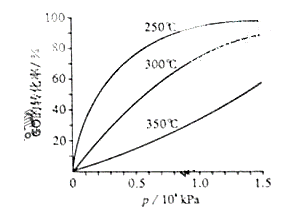
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于充电电池的叙述,不正确的是
A.充电电池的化学反应原理是氧化还原反应
B.充电电池可以无限制地反复放电、充电
C.充电是使放电时的氧化还原反应逆向进行
D.较长时间不使用电器时,最好从电器中取出电池,并妥善存放
查看答案和解析>>
科目:高中化学 来源: 题型:
把m mol C2H4跟n mol H2混合于密闭容器中,在一定条件下发生反应,生成p mol C2H6(p<m),若将反应后的混合气体点燃,完全燃烧生成CO2和H2O时,需要O2的物质的量为
A.(3m+n)mol B.(3m+n/2)mol
C.(3m+3p+n/2)mol D.(3m+n/2-3p)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下硝酸铵分解的化学方程式为5NH4NO3===2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子的物质的量之比为( )。
A.5∶3 B.5∶4
C.1∶1 D.3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
将几滴KSCN(SCN-是“类卤离子”)溶液加入酸性的含有Fe3+的溶液中,溶液变成红色,将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色退去;②向另一份中通入SO2,红色也退去。下列说法不正确的是 ( )。
A.①红色退去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失
B.②红色退去的原因是SO2将Fe3+还原为Fe2+
C.②红色退去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
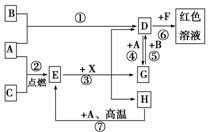
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中 含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加________,该过程的现象为________。
含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加________,该过程的现象为________。
(2)步骤②加入过量H2O2的目的是:__________________________________。
(3)步骤③中反应的离子方程式是:_________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、_______ _、灼烧、________、称量。
_、灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
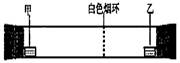
已知气体的摩尔质量越小,扩散速度越快。 右图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是( )
A.甲是浓氨水,乙是浓硫 B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸 D.甲是浓硝酸,乙是浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述正确的是
A.分液时分液漏斗的下端与过滤时漏斗的下端均要贴紧烧杯内壁,其原因相同
B.配制一定物质的量浓度溶液时,在溶解、移液、洗涤、定容时均要用到玻璃棒
C.浓硫酸和浓氢氧化钠溶液溅到皮肤上,均应马上用大量的水冲洗,以防腐蚀皮肤
D.不用其它试剂,只用胶头滴管和试管即可鉴别出NaHCO3、Ba(OH)2、稀H2SO4三种溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com