
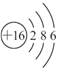

 ,为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物水溶液显碱性,中学阶段碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素.
,为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物水溶液显碱性,中学阶段碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素. ,为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物水溶液显碱性,中学阶段碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素,
,为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物水溶液显碱性,中学阶段碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素, ,故答案为:
,故答案为: ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(1)元素X氢化物的电子式为____________。
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是____________。
(3)元素Z能与氢元素形成一价阴离子,该阴离子的电子总数是____________。
(4)元素W与元素X相比,非金属性较强的是____________(用元素符号表示),下列表述中能证明这一事实的是____________。
①常温下W的单质和X的单质状态不同
②W的氢化物比X的氢化物稳定
③一定条件下W和X的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是____________(用酸的分子式表示),理由是_________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年重庆市高三9月月考理科综合试题(化学部分) 题型:填空题
(15分)X、Y、Z、W是四种短周期元素,X原子的M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;2的最外层电子数与核外电子总数之比为5:7;W元素最高正价为+7价。
(1)元素W在周期表中的位置是_______________
(2)X、W两种元素的气态氢化物中,稳定性强的是_________(填化学式)
(3)在X2W2分子中,每个原子最外层均达到8电子稳定结构,则X2W2的电子式
为_______________.
(4)由Y2H6、O2、KOH溶液组成的燃料电池中。负极上发生的电极反应为___________________________.
(5)在碱性条件下,用W2将废水中的YZ-转化成Z2和YO32-等,从而使废水得到净化,则
其反应的离子方程式为__________________________________
(6)在常温下,0.2mol YX2(液态)在O2中完全燃烧,生成两种气态氧化物时放出的热量为215kJ,该反应的热化学方程式为_______________________________________.
查看答案和解析>>
科目:高中化学 来源:2010-2011学年云南省高三第二次复习统一检测(理综)化学部分 题型:选择题
已知X、Y、Z、W是四种短周期非金属元素,在周期表中的相对位置如下图所示,下列说法不正确的是( )
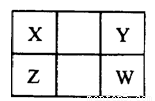
A.Z元素的最高化合价可能比Y元素的高
B.X、Y、Z、W的氢化物中,X的氢化物沸点可能最低
C.Z的单质为原子晶体时,W的单质可能为分子晶体
D.X的最高价氧化物对应水化物与其氢化物不可能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)X、Y、Z、W是四种短周期元素,X原子的M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;2的最外层电子数与核外电子总数之比为5:7;W元素最高正价为+7价。
(1)元素W在周期表中的位置是_______________
(2)X、W两种元素的气态氢化物中,稳定性强的是_________(填化学式)
(3)在X2W2分子中,每个原子最外层均达到8电子稳定结构,则X2W2的电子式
为_______________.
(4)由Y2H6、O2、KOH溶液组成的燃料电池中。负极上发生的电极反应为___________________________.
(5)在碱性条件下,用W2将废水中的YZ-转化成Z2和YO32-等,从而使废水得到净化,则
其反应的离子方程式为__________________________________
(6)在常温下,0.2mol YX2(液态)在O2中完全燃烧,生成两种气态氧化物时放出的热量为215kJ,该反应的热化学方程式为_______________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com