

| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
分析 (1)有金属元素组成的单质属于金属单质;
含有两种元素且一种为氧元素的化合物属于氧化物;
由两种以上物质组成的属于混合物;
分散质粒度介于1-100nm的分散系属于胶体;
水溶液中或者熔融状态下能够导电的化合物属于电解质;
(2)H++OH-=H2O表示可溶性强酸或者强酸的酸式盐与可溶性强碱反应生成水和可溶性盐;
(3)氧化钙与硝酸反应生成硝酸钙和水;
(4)胶体具有丁达尔现象,可以用来鉴别胶体与溶液.
解答 解:(1):①O2属于非金属单质;②Fe属于金属单质;③CaO 属于氧化物,在熔融状态下能够导电,属于电解质;④CO2属于非金属氧化物,本身不能电离,属于非电解质;⑤H2SO4 水溶液中能够导电,属于电解质;⑥Ba(OH)2水溶液中或者熔融状态下能够导电的化合物属于电解质;⑦淀粉溶液中,分散质微粒粒度介于1-100nm,属于胶体;⑧硫酸钠溶液属于混合物;⑨稀硝酸属于混合物;⑩Cu2(OH)2CO3水溶液中或者熔融状态下能够导电的化合物属于电解质;
故答案为:
| 分类标准 | 金属单质 | 溶液 | 胶体 | ||
| 属于该类的物质 | ③④ | ③⑤⑥⑩ |
点评 本题为综合题,考查了物质的分类、离子方程式的书写、胶体的性质,明确基本概念、发生反应的实质是解题关键,题目难度不大,注意对基础知识的积累.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
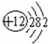 ,⑧
,⑧ ;
;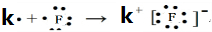 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压下,相同体积的任何气体含有相同数目的原子 | |
| B. | 氧化还原反应的本质是有电子转移 | |
| C. | Na2SO4溶液在电流作用下电离出Na+与SO42-而导电 | |
| D. | NaCl固体不导电,所以NaCl不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
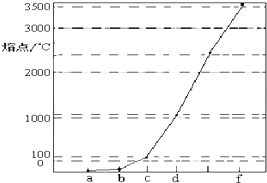
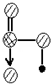 请简要说明该物质易溶于水的原因
请简要说明该物质易溶于水的原因查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 一定条件下,不能和NaOH醇溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
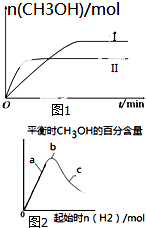 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,22.4 L 氧气所含的分子数目为NA | |
| B. | 44 g 二氧化碳所含的原子数目为NA | |
| C. | 18 g 水所含的电子数目为9 NA | |
| D. | 1 mol 钠作为还原剂所提供的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com