
【题目】硫脲(![]() )是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
)是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
(1)硫脲中硫的化合价为_______;与硫脲互为同分异构且能与FeCl3溶液发生显色反应的化合物的化学式为_______
(2)可用H2NCN(氨基腈)与C2H5SH (乙硫醇)反应制备硫脲。氨基腈的电子式为_____
(3)制取氨基腈的传统工艺流程如下:
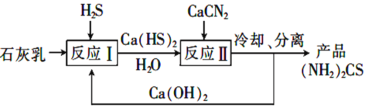
①反应Ⅱ的化学方程式为______
②测定硫脲含量的方法如下:
步骤1 :准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol/L I2的标
准溶液及适量的NaOH溶液,于暗处放置10 min(2NaOH+I2=NaIO+NaI+H2O,
4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2)。
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol/L标准Na2S2O2溶液滴定剩余的I2( I2+2Na2S2O2=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O2溶液V2mL。
“步骤3”加入盐酸的目的_________(用离子方程式说明)。
“步骤4”滴定至终点时的颜色变化是________。
③产品中(NH2)2CS的质量分数为_______ (列出计算式)。
【答案】-2 NH4SCN ![]() 2CaCN2+Ca(HS)2+6H2O=2(NH2)2CS+3Ca(OH)2 IO-+I-+2H+=I2+H2O 由蓝色变为无色
2CaCN2+Ca(HS)2+6H2O=2(NH2)2CS+3Ca(OH)2 IO-+I-+2H+=I2+H2O 由蓝色变为无色 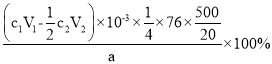
【解析】
(3)石灰乳和H2S反应得Ca(HS)2和H2O,CaCN2、Ca(HS)2和H2O反应得(NH2)2CS和Ca(OH)2,冷却、分离得(NH2)2CS产品,Ca(OH)2循环使用;
NaOH溶液和I2反应得NaIO和NaI,样品溶液中(NH2)2CS和NaIO反应,由于NaOH的具体量没给,所以存在NaIO未完全反应的可能,加HCl将NaIO“还原”为I2(由IO-+I-+2H+=I2+H2O可知,NaIO和I2的物质的量之比=1:1,该步得到的I2的物质的量和未反应的NaIO的物质的量相等),用Na2S2O2溶液反滴定剩余的I2。通过消耗Na2S2O2的量计算剩余的I2,I2的总物质的量减去剩余的I2即为“步骤2”消耗的I2,再根据4I2~4NaIO~(NH2)2CS计算(NH2)2CS的质量,从而计算(NH2)2CS的质量分数。
(1)S和C形成双键,S应显-2价,能与FeCl3溶液发生显色反应的化合物要么含有酚羟基,要么含有SCN-,结合硫脲分子的组成可知,该化合物应为NH4SCN,故答案为:-2;NH4SCN;
(2)每个H原子形成1对共用电子,每个N原子形成3对共用电子,每个C原子形成4对共用电子,所以氨基腈的电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)①由图可知,反应物为CaCN2、Ca(HS)2、H2O,生成物为(NH2)2CS、Ca(OH)2,所以反应Ⅱ的化学方程式为2CaCN2+Ca(HS)2+6H2O=2(NH2)2CS+3Ca(OH)2,故答案为:2CaCN2+Ca(HS)2+6H2O=2(NH2)2CS+3Ca(OH)2;
②“步骤2”后,有一部分NaIO可能有剩余,这样会使测定结果偏大,“步骤3”加HCl的目的是将未反应的NaIO转化为I2,反应的离子方程式为:IO-+I-+2H+=I2+H2O。“步骤4” 用标准Na2S2O2溶液滴定溶液中的I2,以淀粉为指示剂,滴定终点前,溶液中有I2,溶液为蓝色,滴定至终点时,溶液中I2被消耗完,溶液由蓝色变为无色,且30s内不恢复蓝色,故答案为:IO-+I-+2H+=I2+H2O;由蓝色变为无色;
③结合I2+2Na2S2O2=2NaI+Na2S4O6可知,和Na2S2O2反应的I2的物质的量=![]() mol,“步骤2”消耗的I2的物质的量=
mol,“步骤2”消耗的I2的物质的量=![]() mol,由2NaOH+I2=NaIO+NaI+H2O,4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2可知:4I2~4NaIO~(NH2)2CS,所以,溶液中(NH2)2CS的物质的量=
mol,由2NaOH+I2=NaIO+NaI+H2O,4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2可知:4I2~4NaIO~(NH2)2CS,所以,溶液中(NH2)2CS的物质的量=![]() mol。则样品中(NH2)2CS的质量=
mol。则样品中(NH2)2CS的质量=![]() ×76×
×76×![]() g,所以该样品中(NH2)2CS的质量分数=
g,所以该样品中(NH2)2CS的质量分数=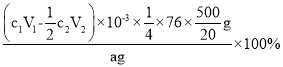 =
=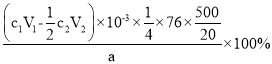 ,故答案为:
,故答案为: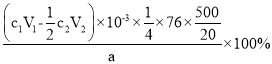 。
。


科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)镍元素基态原子的价电子排布式为________;3d能级上的未成对的电子数为________。
(2)硫酸镍溶于氨水形成![]() 蓝色溶液,
蓝色溶液,![]() 中配体的空间构型是________,阴离子的空间立体构型是________。
中配体的空间构型是________,阴离子的空间立体构型是________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO________FeO(填“![]() ”或“
”或“![]() ”)。
”)。
(4)元素铜与镍的第二电离能分别为:I(Cu)=1959kJ/mol,I(Ni)=1753kJ/mol,I(Cu)> I(Ni)的原因是________。
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图甲所示。该合金的化学式为________。
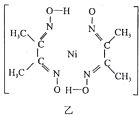
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图乙所示。该结构中,除共价键外还存在配位键和氢键。请在图中用“→”和“…”表示出配位键和氢键。(提示:Ni2+的配位数为4)________。
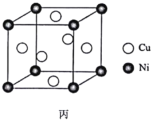
(7)某镍白铜合金的立方晶胞结构如图丙所示。若合金的密度为dg·cm-3,晶胞参数a=________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温条件下,下列对醋酸的叙述中,不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小
C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物 E 是合成某种香料的中间体 ,以苯为原料合成 E 流程如下 :
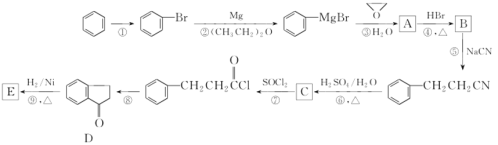
已知:CH3Br![]() CH3 MgBr
CH3 MgBr 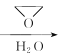 CH3CH 2CH2OH;
CH3CH 2CH2OH;
![]()
![]()
![]()
(1)写出反应①所需的试剂和条件______;
(2)化合物A中碳原子的杂化类型为_____, 分子中不同化学环境的氢原子共有___种;
(3)D中含氧官能团的名称为______;
(4)写出反应⑨的化学方程式_____,该反应的反应类型为_____;
(5)化合物C能与Na2CO3溶液反应生成CO2,符合以下 a 、b 、c、d条件的C的同分异构体与足量NaOH溶液反应的化学方程式___;
a.属于芳香族化合物 b.能发生银镜反应,也能发生水解反应 c. 结构中存在乙基 d苯环上的一氯代物只有 2 种
(6)以![]() 为主要原料,合成
为主要原料,合成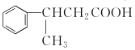 的流程为_________。
的流程为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吊白块(NaHSO2HCHO2H2O,次硫酸氢钠甲醛)是易溶于水的白色块状或结晶性粉状固体,在印染工业中被用作拔染剂和还原剂。可由Na2S2O5 (焦亚硫酸钠)、甲醛及锌粉反应制取,回答下列问题:
(1)已知在pH=4.1时的过饱和NaHSO3溶液将自动脱水生成Na2S2O5,制备原料Na2S2O5的装置如下。
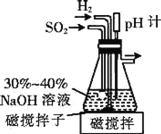
①通入H2的目的是______。
②吸滤瓶中先后发生的反应为_______、2NaHSO3=Na2S2O5↓+H2O。
③从环境保护和安全考虑,下列尾气处理方法正确的是________(填标号)。
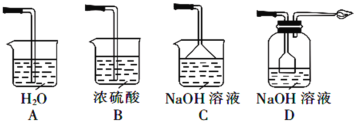
④实验室用稀NaOH溶液不能制得Na2S2O5,是因为_______。
(2)制备吊白块的装置(夹持及加热装置已略)如图:
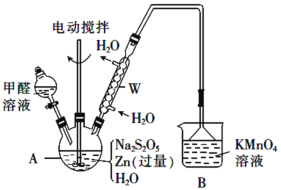
①仪器A的名称是_________。
②制备反应需在950C下进行,合适的加热方式是_____,A中发生反应的化学方程式为_____(Zn转化为等物质的量的ZnO和Zn(OH)2)。
③从A中的悬浊液中得到产品吊白块的实验操作是_________及干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物X、Y、Z、M的相互转化关系如图所示(部分反应条件、部分反应中的H.,O已略去)。X、Y、Z均含有同一种元素。下列说法正确的是

A. 若X是氢氧化钠,则M不一定为CO2
B. 若Y具有两性,则M的溶液只可能显碱性
C. 若Z是导致酸雨的主要气体,则X一定是H2S
D. 若M是用途最广的金属,加热蒸干Y的溶液一定能得到Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用PCl5作为制造乙酰纤维素的催化剂,也常用于手性药品的研发,在材料,医药工业得到了广泛应用,请回答下列问题:
(1)PCl5在固态是离子化合物,相对式量为417,其阳离子为![]() ,则阴离子的化学式为_______。
,则阴离子的化学式为_______。
(2)已知: P(s) + ![]() Cl2(g) = PCl3(g) H= -306 KJ/mol
Cl2(g) = PCl3(g) H= -306 KJ/mol
PCl5(g) = PCl3(g) + Cl2(g) H= + 93 KJ/mol
则反应2P(s) + 5Cl2(g) = 2PCl5(g)的H=______kJ/mol。
(3)温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,容器中发生反应:PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/min | 0 | 10 | 20 | 30 | 40 |
n(PCl3)/mol | 0 | 0.12 | 0.17 | 0.2 | 0.2 |
①反应在前10min的平均速率v(PCl5)=_______;
②不能表明该反应达到平衡状态的是:____ (选填序号);
a.容器的总压强不再改变
b.混合气体的平均相对分子质量不变
c.v正(PCl3)等于v逆(Cl2)
d.混合气体的密度不变
e.PCl5的质量不再变化
③要提高上述反应的转化率,可采取的措施有(至少两种)___________;
④该温度下,反应PCl5(g)PCl3(g) + Cl2(g)的平衡常数Kp=2.25×105(Kp为压强平衡常数,Kp=![]() )。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
)。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
(4)在热水中,五氯化磷完全水解,生成磷酸和盐酸。若将0.01molPCl5投入热水中配成lL溶液,再逐滴加入AgNO3溶液,先产生的沉淀是_____。 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com