
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 离子还原性:A(n+1)+>Bn+,离子氧化性:C(n+1)->Dn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
分析 已知aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则有:a-n-1=b-n=c+n+1=d+n,A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,结合元素周期律递变规律解答该题.
解答 解:A.aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则有:a-n-1=b-n=c+n+1=d+n,则有A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,故A错误;
B.具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径为C(n+1)->Dn->Bn+>A(n+1)+,故B错误;
C.金属性越强,对应离子的氧化性越弱,非金属性越强,对应离子的还原性越强,则离子还原性为C(n+1)->Dn-,离子氧化性为Bn+<A(n+1)+,故C错误;
D.同周期从左向右金属的还原性减弱,单质的氧化性增强,则单质还原性为B>A,单质氧化性为D>C,故D正确;
故选D.
点评 本题考查位置结构性质的相互关系及应用,明确核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素丙的单质可用于冶炼金属 | B. | 甲与丁形成的分子是酸性氧化物 | ||
| C. | 简单离子半径:丁>乙>丙 | D. | 甲与乙形成的化合物均有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用核磁共振氢谱可以鉴别乙醇和甲醚 | |
| B. | 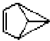 的一氯代物有4种 的一氯代物有4种 | |
| C. | 金刚烷( )分子中含有4个 )分子中含有4个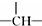 | |
| D. | 环戊二烯( )分子中最多有9个原子在同一平面上 )分子中最多有9个原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯是一种油状物质,会浮在水面上 | |
| B. | 实验室制硝基苯需要用水浴加热,控制温度在50℃~60℃ | |
| C. | 硝基苯中毒是由蒸气吸入或误食引起的,与皮肤接触不会引起中毒 | |
| D. | 硝基苯是由甲苯和硝酸直接反应生成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热,用湿润的红色石蕊试纸置于试管口检验 | |
| B. | 加强碱溶液后加热,再滴入无色酚酞试液 | |
| C. | 加热,用蘸有浓盐酸的玻璃棒置于试管口检验 | |
| D. | 加烧碱溶液后加热,再用湿润的红色石蕊试纸置于试管口检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ③⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑤ | ⑦ | ⑨ | |||||
| 第3周期 | ① | ③ | ⑥ | ④ | ⑧ | ⑩ | ||
| 第4周期 | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将食物置于冰箱中冷藏保存 | B. | 将FeCl3加入H2O2溶液中制备O2 | ||
| C. | 将洗衣粉溶于温水后洗涤衣服 | D. | 将CaCO3固体研磨后再与稀HCl反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com