
| A. | 氢气还原氧化铜 | B. | 高锰酸钾分解 | ||
| C. | 锌放入稀硫酸 | D. | 碳和水蒸气在高温下反应 |
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铜和硝酸反应:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO+7H20,属于氧化还原反应 | |
| B. | Cl2+SO2+2H2O═H2SO4+2HCl属于氧化还原反应 | |
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)2属于氧化还原反应和化合反应 | |
| D. | 金属单质与盐溶液的反应都是置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8gO2和1gH2体积为1:2 | B. | NH3和H2S密度比为1:2 | ||
| C. | 5L N2和4L CH4原子数比为1:2 | D. | 2mol CO2和1mol CO分子数比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3中混杂的NaCl | 重结晶 | 氯化钠在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
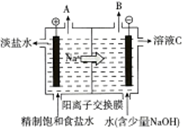 电解饱和食盐水的原理如图所示.
电解饱和食盐水的原理如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com