
根据题目提供的溶度积数据进行计算并回答下列问题:
(1)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为____________________。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________。
②完全沉淀后,溶液的pH=__________。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?________________(填“是”或“否”)。
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为__________________。
答案 (1)蓝色
(2)①1.0×10-7 mol·L-1 ②2 ③否
(3)4×10-3 mol·L-1
解析 (1)设Mg(OH)2饱和溶液中c(OH-)为x mol·L-1,则0.5x3=5.6×10-12,x>1×10-4,c(H+)<1×10-10 mol·L-1,pH>10,溶液为蓝色。(2)①反应前,n(Ag+)n(Ag+)=0.018 mol·L-1×0.05 L=0.9×10-3 mol,n(Cl-)=0.020 mol·L-1×0.05 L=1×10-3 mol;反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol·L-1,c(Ag+)=Ksp(AgCl)/c(Cl-)=1.0×10-7 mol·L-1。②H+没有参与反应,完全沉淀后,c(H+)=0.010 mol·L-1,pH=2。③因为加入的盐酸中c(Cl-)和反应后所得溶液中的c(Cl-)相同,c(Cl-)没有改变,c(Ag+)变小,所以Qc=c(Ag+)·c(Cl-)<Ksp(AgCl),没有沉淀产生。
(3)根据Ksp(FeS)得:c(S2-)= =6.25×10-18mol·L-1,根据c2(H+)·c(S2-)=1.0×10-22得:c(H+)=
=6.25×10-18mol·L-1,根据c2(H+)·c(S2-)=1.0×10-22得:c(H+)= 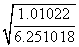
=4×10-3 mol·L-1。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
某高分子化合物R的结构简式为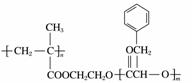 ,下列有关R的说法正确的是( )
,下列有关R的说法正确的是( )
A.R的一种单体的分子式为C9H10O2
B.R完全水解后的生成物均为小分子有机物
C.可以通过加聚反应和缩聚反应合成R
D.碱性条件下,1 mol R完全水解消耗NaOH的物质的量为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
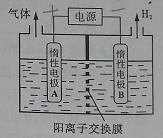
利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________ ,电解过程中Li+向_____电极迁移(填“A”或“B”)。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
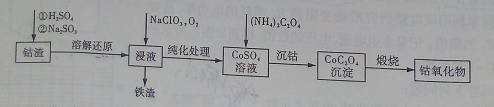
Co(OH)3溶解还原反应的离子方程式为____________________________________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某种橡胶分解产物为碳氢化合物,对这种碳氢化合物进行以下实验:
①若取一定量的橡胶完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72 g,再通过足量的石灰水,石灰水增重2.2 g。
②经测定,该碳氢化合物(气体)的密度是相同状况下氢气密度的34倍。
③该碳氢化合物0.1 mol最多能和32 g溴发生加成反应。
④经分析,在③的生成物中,溴原子分布在主链上不同的碳原子上,且溴代物中有一个碳原子在支链上。
试推断:
(1)该碳氢化合物的结构简式是 ,名称是 。
(2)该橡胶的结构简式是 ,名称是 。
(3)写出0.1 mol该化合物与32 g溴反应的化学方程式。
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度( )
(2)不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时,沉淀已经完全( )
(3)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀( )
(4)常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小( )
(5)溶度积常数Ksp只受温度影响,温度升高Ksp增大( )
(6)常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变( )
查看答案和解析>>
科目:高中化学 来源: 题型:
溴酸银(AgBrO3)溶解度随温度变化曲线如下图所示。下列说法错误的是( )
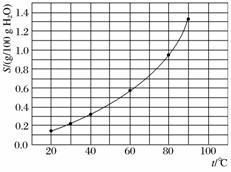
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解。为得到纯净的氯化钠,有人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。对此有下列说法,其中正确的是( )
A.食盐颗粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中,NaCl的物质的量浓度会变大
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa下:
①2Na(s)+1/2O2(g)====Na2O(s) ΔH1=-414 kJ·mol-1
②2Na(s)+O2(g)====Na2O2(s) ΔH2=-511 kJ·mol-1
下列说法正确的是:
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.0 ℃、101 kPa ,1molNa在O2中完全燃烧放出255.5KJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
某烷烃的结构简式为
(1)用系统命名法命名该烃:_______________________________________________________。
(2)若该烷烃是由烯烃和1 mol H2加成得到的,则原烯烃的结构有__________种。(不包括立体异构,下同)
(3)若该烷烃是由炔烃和2 mol H2加成得到的,则原炔烃的结构有__________种。
(4)该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com