
【题目】Ⅰ、有下列五种烃:①![]() ②
②![]() ③乙烷 ④戊烷 ⑤
③乙烷 ④戊烷 ⑤![]() ,其中互为同分异构体的是____________(填序号),②与⑤之间的关系为_____________,
,其中互为同分异构体的是____________(填序号),②与⑤之间的关系为_____________,
②③④⑤四种物质按它们的沸点由高到低的顺序排列正确的是_____________(填序号)
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
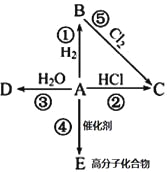
(1)写出A的电子式________,E的结构简式为______________
(2)写出下列反应化学方程式,并注明③⑤反应类型
② _____________________________________________
③ _____________________ ,反应类型________;
⑤ _____________________ ,反应类型________;
(3)除去B中混有的少量杂质A,所用的试剂为___________
【答案】②④ 同系物 ④②⑤③ ![]()
![]() CH2=CH2+HCl
CH2=CH2+HCl![]() CH3CH2C l CH2=CH2+H2O
CH3CH2C l CH2=CH2+H2O![]() CH3CH2OH 加成反应 CH3CH3+Cl2
CH3CH2OH 加成反应 CH3CH3+Cl2![]() CH3CH2Cl+HCl 取代反应 溴水
CH3CH2Cl+HCl 取代反应 溴水
【解析】
Ⅰ、②④分子式相同,结构不同,属于同分异构体;②与⑤结构相似,相差CH2,二者关系为同系物;烷烃碳原子数越多,沸点越高,相同碳原子数的烷烃,支链越多,沸点越低,故四种物质的沸点由高到低的顺序为④②⑤③;
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,故为乙烯,根据转化关系知:B为乙烷,C为氯乙烷,D为乙醇,E为聚乙烯;
(1) A为乙烯,其电子式为:![]() ,E的结构简式为
,E的结构简式为![]() ;(2)②的反应化学方程式为CH2=CH2+HCl
;(2)②的反应化学方程式为CH2=CH2+HCl ![]() CH3CH2Cl,③的反应化学方程式为CH2=CH2+H2O
CH3CH2Cl,③的反应化学方程式为CH2=CH2+H2O ![]() CH3CH2OH,属于加成反应;⑤的反应化学方程式为CH3CH3+Cl2
CH3CH2OH,属于加成反应;⑤的反应化学方程式为CH3CH3+Cl2![]() CH3CH2Cl+HCl,属于取代反应;
CH3CH2Cl+HCl,属于取代反应;
(3)除去乙烷中混有的少量杂质乙烯,可以选用溴水。


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为:Zn-2e-+2OH-![]() ZnO+H2O、Ag2O+2e-+H2O
ZnO+H2O、Ag2O+2e-+H2O![]() 2Ag+2OH-,总反应式为Ag2O+Zn
2Ag+2OH-,总反应式为Ag2O+Zn![]() ZnO+2Ag
ZnO+2Ag
根据上述反应式,回答下列问题:
(1)Zn是_______极,发生______反应,Ag2O发生______反应(填“氧化”或“还原”)。
(2)电子流向_______,当电路中通过1 mole-时,负极消耗物质的质量是_______g。(已知:Zn的原子量为65)
(3)在使用过程中,电解质溶液中KOH的物质的量_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是______________色固体,与CO2反应的化学方程式_________________________________________.因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,则下列说法正确的是( )
A. 标准状况下,11. 2L CCl4所含的分子数为0. 5NA
B. 常温常压下,4. 2g C2H4和C8H16混合物中含有的碳原子数为0. 3NA
C. 7. 8g苯分子中碳碳双键的数目为0. 3NA
D. 60g丙醇中存在的共价键总数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CaCO3难溶于水,是弱电解质
B. 进行中和滴定操作时眼睛应注视锥形瓶中溶液颜色的变化
C. 用pH试纸测溶液的pH应预先润湿
D. 蒸干FeCl3溶液可得到FeCl3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,a是较活泼的金属,b是常温下化学性质很不活泼且能导电的碳棒。下列关于装置的叙述不正确的是( )
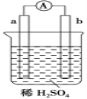
A. 碳棒上有气体产生
B. a是正极,b是负极
C. 导线中有电子流动,其流向为从a极到b极
D. a极上发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4在生产、生活、卫生医疗中常用作消毒剂,高锰酸钾造成的污渍可用还原性的草酸(H2C2O4 )去除,Fe(NO3)3也是重要氧化试剂,下面是对这两种氧化剂性质的探究。
(1)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量的是________mol。
(2)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.395 g KMnO4样品溶解酸化后,用0.100 mol/L标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在________(填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗Na2S2O3溶液12.50 mL,则该样品中KMnO4的质量分数是________。(有关离子方程式为:8MnO4-+5S2O32-+14H+=8Mn2++10SO42-+7H2O)
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。溶液先变为浅绿色的离子方程式是_______________,又变为棕黄色的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。下列说法错误的是( )

A. 溶液中K+向电极b移动
B. 氨气在电极a上发生氧化反应
C. 反应消耗的NH3与O2的物质的量之比为4:3
D. 正极的电极反应式为:O2+4e-+2H2O=4OH-,故反应一段时间后,电解液的pH升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com