
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)FeO42-与水反应的方程式为:4FeO42- + 10H2O  4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是 和 。
(2)将适量K2FeO4配制成c(FeO42-) =1.0×10-3 mol·L-1(1.0mmol·L-1)的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。题(1)中的反应为FeO42-变化的主反应,该反应的△H 0。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4- H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近 (填字母)。
H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近 (填字母)。
A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL,1.0×10-3 mol·L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量为 mol,
完全沉淀后溶液中残留的c(FeO42- )为______________。
(1)杀菌消毒,吸附杂质(2)>(3)BD(4)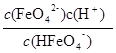 C(5)4.536×10-5,1×10-5mol/L
C(5)4.536×10-5,1×10-5mol/L
解析试题分析:(1)FeO42-具有强氧化性,能消毒杀菌;FeO42-与水生成的Fe(OH)3胶体能吸附水中的悬浮物,使水体净化。(2)由图I可以看出,温度越高,溶液中c(FeO42-)越小,说明升高温度,平衡向右移动,所以正反应是吸热反应。(3)由图可知当pH小于1.5时,溶液中只有H3FeO4+和H2FeO4,A错误;pH由10降至4时,HFeO4-的分布分数先增大后减小,B正确;向pH=8的该溶液中加KOH溶液,pH增大,离子方程式为HFeO4-+OH-=FeO42-+H2O,C错误;pH约为2.5 时, H3FeO4+和HFeO4-分布分数相等,D正确。(4)HFeO4- H++FeO42-的电离平衡常数K=
H++FeO42-的电离平衡常数K=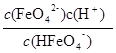 ,当pH接近7时,c(FeO42-)=c(HFeO4-),K≈10-7。(5)要形成CaFeO4沉淀,必须c(Ca2+)·c(FeO42-)>Ksp(CaFeO4)。
,当pH接近7时,c(FeO42-)=c(HFeO4-),K≈10-7。(5)要形成CaFeO4沉淀,必须c(Ca2+)·c(FeO42-)>Ksp(CaFeO4)。
考点:勒沙特列原理 溶度积计算 电离平衡常数 图像的分析
点评:勒沙特列原理适用于所有平衡体系;两种溶液混合,形成沉淀的条件是Q>Ksp。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com