
【题目】现有浓度均为0.1molL-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵。请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)__。
(2)已知T℃,KW=1×10-13,则t℃___25℃(填“>”、“<”或“=”)。在T℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=_。
(3)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=__(填数据);
②若x+y>14,则a/b=__(填表达式);
③该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为__(填表达式)。
【答案】④②③① > 101:9 1 10x+y-14 x+y=14+lg![]()
【解析】
(1)氯化铵促进水的电离,硫酸、醋酸、氢氧化钠抑制水的电离,酸中氢离子浓度或碱中氢氧根离子浓度越大,水的电离程度越小;
(2)水的电离是吸热,温度升高促进电离,水的离子积增大;
若所得混合溶液的pH=10,溶液呈碱性,氢氧化钠有剩余,表示出剩余氢氧化钠的浓度,结合混合溶液的pH=10计算;
(3)盐酸与氢氧化钠恰好中和,则n(HCl)=n(NaOH),可得a×10-x=b×![]() ,整理可得:
,整理可得:![]() =10x+y-14。
=10x+y-14。
![]() 向溶液中加入酸或碱均能抑制
向溶液中加入酸或碱均能抑制![]() 的电离,且溶液中
的电离,且溶液中![]() 或
或![]() 浓度越大,由水电离出的
浓度越大,由水电离出的![]() 浓度越小;盐的水解能促进水的电离,所以由水电离出
浓度越小;盐的水解能促进水的电离,所以由水电离出![]() 由大到小的顺序为:
由大到小的顺序为:![]() ;
;
![]() 水的电离过程是吸热反应,升温促进水的电离,即升温
水的电离过程是吸热反应,升温促进水的电离,即升温![]() 增大,
增大,![]() 时
时![]() ,即
,即![]() ;在
;在![]() 时在aL
时在aL![]() 的NaOH溶液中,
的NaOH溶液中,![]() ,
,![]() 的bL
的bL![]() 溶液中,
溶液中,![]() ,根据混合后溶液
,根据混合后溶液![]() ,得
,得![]() ,解得a:
,解得a:![]() :9;
:9;
![]() 两溶液完全中和,则溶液中
两溶液完全中和,则溶液中![]() ,即
,即![]() ,整理得:
,整理得:![]() ;
;
![]() 若
若![]() 时,
时,![]() =1;
=1;
![]() 若
若![]() ,则
,则![]() 。
。
![]() 两溶液完全中和,则有
两溶液完全中和,则有![]() 即
即![]() ,解得:
,解得:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中充入A2和B2,一定条件下发生反应A2+B2![]() 2AB(正反应为吸热反应),其反应速率与时间的关系如图所示。
2AB(正反应为吸热反应),其反应速率与时间的关系如图所示。

下列说法错误的是( )
A.t1时,v(正反应)>v(逆反应)
B.t2时,v(正反应) = v(逆反应)
C.图中虚线表示的转化是A2+B2→2AB
D.升高温度和加催化剂,均有利于加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)为用途极广的铬化合物,供制铬矾。火柴、铬颜料、并供鞣革、电镀、有机合成等用。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程如图所示:

根据题意回答下列问题:
(1)锻烧时,铬铁矿发生复杂反应生成Na2CrO4和NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式是___。
(2)NaFeO2遇水强烈水解生成滤渣l的反应离子方程式是___。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7-8目的是___,滤液2调节pH约为5目的是___。
物质 | 溶解度/(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。此法能够制得K2Cr2O7晶体的原因是:___;为了从溶液中得到较多K2Cr2O7晶体的操作过程是:___、过滤、洗涤、干燥。将得到的K2Cr2O7晶体进一步纯化操作是:___。
(5)K2Cr2O7性质:往K2Cr2O7溶液中加入AgNO3溶液,生成一种砖红色沉淀、溶液的pH减小,反应离子方程式是___。
(6)K2Cr2O7产品含量测定:准确称取试样2.5g配成250mL溶液,用移液管吸取25.00mL溶液放入碘量瓶,加入10mL2mol/L硫酸、2gKI于暗处5min,另加100mL水,用0.2000mol/L Na2S2O3标准液滴定至溶液黄绿色,再加3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。平行三次实验,平均消耗Na2S2O3标准液的体积25.00mL。K2Cr2O7产品的纯度为___。
有关反应如下:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O
2Na2S2O3+I2=Na2S4O6+2NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应:①M(s)+N(g) R(g) ΔH= - Q1 kJ/mol
②2 R(g)+N(g) 2T(g) ΔH= - Q2 kJ/mol(已知Q1、Q2、Q3均为正值)
下列说法正确的是
A. 1molR(g)的能量总和大于1molM(s)与1molN(g)的能量总和
B. 将2mol R(g)与1molN(g)充分混合,在一定条件下充分反应,放出热量Q2 kJ
C. 当1molM(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+0.5Q2)kJ
D. M(g)+N(g) R(g) ΔH= - Q3 kJ/mol,则Q3 < Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫、氮及其化合物在工农业、国防等领域占有重要地位。
(1)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若16gCH4和NO2充分反应,生成N2、CO2(g)和H2O(g),共放出热量867kJ,则△H2=___。
(2)工业生产中产生的SO2废气若用Na2SO3溶液吸收,得到浓度均为0.1mol·L-1的Na2SO3、NaHSO3混合溶液,则![]() =__。经测定,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为___。
=__。经测定,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为___。
(3)N2O4与NO2之间存在反应N2O4(g)2NO2(g)。在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率-分压强关系如图所示,一定温度下,k1、k2与平衡常数Kp(用平衡分压代替平衡浓度计算)的关系是k1=__,在图上标出的点中,能表示反应达到平衡状态的点为__(填字母代号)。

(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1molN2时,转移的电子为___mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将2.0 mol PCl3(g)和1.0 mol Cl2(g)充入体积不变的1L密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,平衡时PCl5为0.4 mol,如果此时移走1.0 mol PCl3和0.5 molCl2,在相同条件下再达平衡时PCl5的物质的量是
PCl5(g) △H<0,平衡时PCl5为0.4 mol,如果此时移走1.0 mol PCl3和0.5 molCl2,在相同条件下再达平衡时PCl5的物质的量是
A.0.4molB.0.2molC.小于0.2molD.大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸HA溶液中![]() =1×10-12,下列说法中正确的是
=1×10-12,下列说法中正确的是
A. 溶液中由水电离出的c(H+)=1×10-10mol·L-1
B. 溶液中存在HA![]() H++A-
H++A-
C. 与0.1 mol·L-1NaOH溶液等体积混合后所得溶液为中性
D. 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向新制氯水中逐滴滴加NaOH溶液,溶液pH随时间的变化如图所示。呈碱性时停止滴加,一段时间后溶液黄绿色逐渐褪去。由此得不到的结论是

A.该新制氯水c(H+)=10-2.6mol/L
B.开始阶段,pH迅速上升说明H+被中和
C.OH-和Cl2能直接快速反应
D.NaOH和氯水反应的本质是OH-使Cl2+H2O![]() H++Cl-+HClO平衡右移
H++Cl-+HClO平衡右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
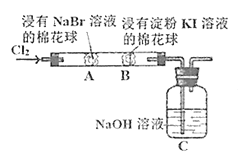
A.A处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.B处棉花球变成蓝色,说明Br2的氧化性比I2强
C.A处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2
D.C装置中与NaOH溶液反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com