
���� ��1�����淴Ӧ����ƽ��ʱ��ͬ�����ʵ�������������ұ��ֲ��䣬����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯˵������ƽ�⣻
����Ӧ�����ȷ�Ӧ�������������䣬�¶�����ƽ�������ƶ���NO2��Ũ������
��2������Ŀ��Ϣ��֪����ij��֣�B����ƽ��ѹǿ��PB����ʾƽ�ⳣ��Ϊ���������ѹ��ϵ�����ݳ˻��뷴Ӧ���ѹϵ�����ݳ˻��ıȣ�
ƽ�ⳣ��ֻ���¶��¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣻
��3��ƽ��ʱ����������ȣ���v��=k����p��N2O4����v��=k����p2��NO2���������ɵ�Kp��
���������������ķֽ��ʼ����������ʵ������������������������ķ�ѹp��N2O4�����ٸ���v��=k����p��N2O4�����㣻
��4�������¶Ȳ��䣬ƽ�ⳣ�����䣬����ƽ�ⳣ��Kp=$\frac{{[p}_{��}��x��N{O}_{2}��]^{2}}{{p}_{��}��x��{N}_{2}{O}_{4}��}$=$\frac{{p}_{��}��{x}^{2}��N{O}_{2}��}{x��{N}_{2}{O}_{4}��}$���㣮
��� �⣺��1��a��Ӧ��2v����N2O4��=v����NO2�� ʱ��Ӧ�ﵽƽ��״̬����a����
b����ϵ��ɫ���䣬˵����������Ũ�Ȳ��䣬��Ӧ����ƽ��״̬����b��ȷ��
c������������������䣬�淴Ӧ��С������������ʵ�������ƽ����Է���������С��������ƽ����Է�����������ʱ����Ӧ����ƽ��״̬����c��ȷ��
d�������������������䣬�������ݻ����䣬�����ܶ�ʼ�ղ��䣬��d����
����Ӧ�����ȷ�Ӧ�������������䣬�¶�����ƽ�������ƶ���c��NO2�����ӣ���ɫ���
�ʴ�Ϊ��bc���������Ӧ�����ȷ�Ӧ�������������䣬�¶�����ƽ�������ƶ���c��NO2�����ӣ���ɫ���
��2������Ŀ��Ϣ��֪����ij��֣�B����ƽ��ѹǿ��PB����ʾƽ�ⳣ��Ϊ���������ѹ��ϵ�����ݳ˻��뷴Ӧ���ѹϵ�����ݳ˻��ıȣ�N2O4��g��?2NO2��g����ƽ�ⳣ��Kp=$\frac{{[p}_{��}��x��N{O}_{2}��]^{2}}{{p}_{��}��x��{N}_{2}{O}_{4}��}$=$\frac{{p}_{��}��{x}^{2}��N{O}_{2}��}{x��{N}_{2}{O}_{4}��}$��ƽ�ⳣ��ֻ���¶��¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬
�ʴ�Ϊ��$\frac{{p}_{��}��{x}^{2}��N{O}_{2}��}{x��{N}_{2}{O}_{4}��}$���¶ȣ�
��3��ƽ��ʱ����������ȣ���v��=k����p��N2O4����v��=k����p2��NO2���������ɵ�Kp=$\frac{{K}_{��}}{K��}$��
��N2O4�ֽ�10%ʱ����Ͷ���N2O4Ϊ1mol��ת����N2O4Ϊ0.1mol����
N2O4��g��?2NO2��g�� ���ʵ��������n
1 2-1=1
0.1mol 0.1mol
�ʴ�ʱp��N2O4��=$\frac{1mol-0.1mol}{1mol+0.1mol}$��100kPa=$\frac{9}{11}$��100kPa����v��=4.8��l04s-1��$\frac{9}{11}$��100kPa=3.9��106 kPa•s-1��
�ʴ�Ϊ��$\frac{{K}_{��}}{K��}$��3.9��106��
��4�����¶�ΪTʱ��ƽ��ʱN2O4�ֽ�ٷ���Ϊa����Ͷ���N2O4Ϊ1mol��ת����N2O4Ϊamol����
N2O4��g��?2NO2��g��
��ʼ����mol����1 0
�仯����mol����a 2a
ƽ������mol����1-a 2a
��x��N2O4��=$\frac{1-a}{1+a}$��x��NO2��=$\frac{2a}{1+a}$��
��ƽ�ⳣ��Kp=$\frac{{[p}_{��}��x��N{O}_{2}��]^{2}}{{p}_{��}��x��{N}_{2}{O}_{4}��}$=$\frac{{p}_{��}��{x}^{2}��N{O}_{2}��}{x��{N}_{2}{O}_{4}��}$=p0��$\frac{��\frac{2a}{1+a}��^{2}}{\frac{1-a}{1+a}}$
�����¶Ȳ��䣬ƽ�ⳣ�����䣬��N2O4��ƽ��ֽ���Ϊy����
p0��$\frac{��\frac{2a}{1+a}��^{2}}{\frac{1-a}{1+a}}$=2p0��$\frac{��\frac{2y}{1+y}��^{2}}{\frac{1-y}{1+y}}$��
���y=$\sqrt{\frac{{a}^{2}}{2-{a}^{2}}}$��
�ʴ�Ϊ��$\sqrt{\frac{{a}^{2}}{2-{a}^{2}}}$��
���� ���⿼�黯ѧƽ��״̬�жϡ���ѧƽ�ⳣ������ѧ��Ӧ���ʵȣ���Ŀ�漰��ĸ�ͼ��㣬Ϊ�״���Ŀ�����ؿ���ѧ����Ϣ��ȡ��֪ʶǨ�����ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
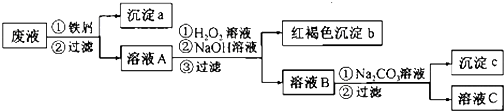
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2��CsCl��CBr4��CF4 | B�� | CF4��CCl4��CBr4��Cl4 | ||
| C�� | ���ʯ������裾�������裾̼���� | D�� | NaF��MgF2��AlF3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ�������£���1 mol N2��3 mol H2��ϣ���ַ�Ӧ��ת�Ƶĵ�����Ϊ6 NA | |
| B�� | 1.5 mol NO2������ˮ��Ӧ��ת�Ƶĵ�����Ϊ1.5 NA | |
| C�� | 6.4 g��S2��S4��S8��ɵĻ���ﺬ��ԭ����Ϊ0.2 NA | |
| D�� | ���³�ѹ�£�11.2 L Cl2����ԭ����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
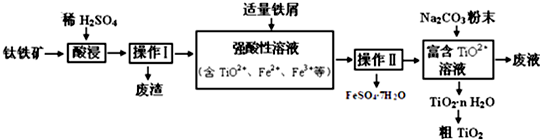
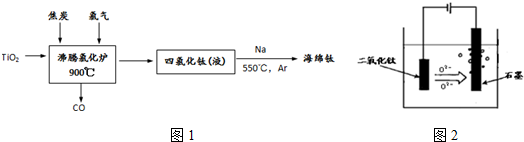
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
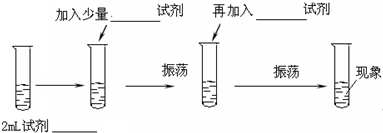
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaCl2��Na2CO3 | B�� | ϡ�����Na[Al��OH��4] | C�� | ϡ�����Na2CO3 | D�� | NaOH��AlCl3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com