
【题目】LiOH常用于制备锂离子电池正极材料。工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法正确的是

A. a是电源的负极
B. A电极的电极反应式为4OH--4e-===2H2O+O2↑
C. B极区电解液为LiOH溶液
D. 外电路中每通过0.1 mol电子,生成1.12 L氢气
【答案】C
【解析】
根据图知,B电极上有氢气生成,则B为电解池阴极,A为阳极,a为正极、b为负极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,阳极反应式为2Cl—2e-=Cl2↑,结合电荷守恒计算。
根据图知,B电极上有氢气生成,则B为电解池阴极,A为阳极,a为正极、b为负极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,阳极反应式为2Cl—2e-=Cl2↑,
A.根据以上分析知,a是正极、b是负极,故A错误;
B. A电极上氯离子放电,电极反应式为2Cl—2e-=Cl2↑,故B错误;
C.A极区是阳极区、B极区是阴极区,B电极反应式为2H2O+2e-=2OH-+H2↑,有氢氧根离子生成,所以B极区电解液为LiOH溶液,A极区电解质溶液为LiCl溶液,所以C选项是正确的;
D.阴极电极反应式为2H2O+2e-=2OH-+H2↑,所以有0.1 mol电子转移,根据电子守恒知,生成氢气0.05mol,标准状况下体积为:0.05mol![]() 22.4L/mol=1.12L,但温度压强不知,不能计算气体体积,故D错误。
22.4L/mol=1.12L,但温度压强不知,不能计算气体体积,故D错误。
所以C选项是正确的。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1molH2SO4的质量为98g·mol-1 B. H2SO4的摩尔质量为98g
C. 1molO2体积是22.4L D. 1molO2约有6.02×1023个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池能量转化的主要形式是____________________________________________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为________________________________________________________________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②金属锂吸收的氢气与放出的氢气的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示。则下列结论正确的是
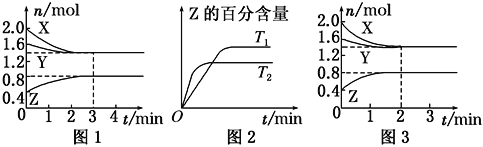
A. 容器中发生的反应可表示为3X(g)+Y(g) ==2Z(g)
B. 反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1
C. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D. 保持其他条件不变,升高温度,反应的化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,错误的是( )
A.苯酚在水中的溶解度随温度的升高而增大
B.苯酚易溶于乙醇等有机溶剂
C.苯酚没有毒,其稀溶液可用作防腐剂和消毒剂
D.苯酚水溶液呈弱酸性,能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为__________,有较强的_________(填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_________。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为_____________________。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是__________。该图示的总反应为_______
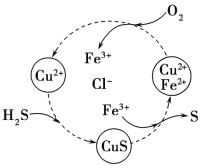
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 kJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 kJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3kJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少kJ
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2
C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com