
| A、用简易量热计能粗略测量稀盐酸和烧碱稀溶液中和反应的反应热 |
| B、pH<7的溶液不可能呈中性 |
| C、所有化学反应的反应热均可通过实验直接测定 |
| D、铅酸蓄电池充电和放电时的所发生的反应互为可逆反应 |


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
| H2SO4 |
| NaOH |
| NaOH |
| H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
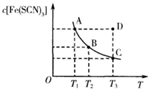 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A、A点与B点相比,A点的c( Fe3+)大 |
| B、反应处于D点时,一定有v正<v逆 |
| C、加入KCl固体可以使溶液由D点变到C点 |
| D、若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Q2=Q1<Q |
| B、2Q2<Q1=Q |
| C、2Q2<Q1<Q |
| D、Q1=2Q2=Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单核阳离子的电子层结构(除氢外)一定与上一周期稀有气体原子相同 |
| B、单核阳离子的电子层数一定比其他原子的电子层数少 |
| C、单核阴离子的半径一定比其原子半径大 |
| D、单核阴离子最外层一定是八电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 热化学方程式 | 结 论 | |
| A | 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol | 氢气的燃烧热为241.8kJ/mol |
| B | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol | 含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
| C | 2C(s)+2O2(g)=2CO2(g)△H=-a kJ/mol 2C(s)+O2(g)=2CO(g)△H=-b kJ/mol | b>a |
| D | C(石墨,s)=C(金刚石,s)△H=+1.5kJ/mol | 石墨比金刚石稳定 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com