
| A、25℃、101kPa 下,Na2O2(s)+2 Na(s)=2Na2O(s)△H=-317kJ/mol |
| B、①和②生成等物质的量的产物,转移电子数不同 |
| C、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D、①和②产物的阴阳离子个数比不相等 |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
| A、1 mol液态水的质量 |
| B、1 mol水蒸气的质量 |
| C、1 mol液态水的体积 |
| D、1 mol水蒸气的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种.现做如下实验:
有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种.现做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
 -COOH.A、B、C、D、E的相互转化关系如图所示:
-COOH.A、B、C、D、E的相互转化关系如图所示:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CO | H2 | CH3OH |
| 物质的量/(mol) | 0.4 | 0.4 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
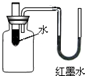 向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是( )
向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是( )| A、氢氧化钠 | B、硝酸铵 |
| C、浓硫酸 | D、生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、CaCO3难溶于水,溶液中没有Ca2+和CO32- |
| C、升高温度,CaCO3沉淀的溶解度无影响 |
| D、向CaCO3沉淀中加入Na2CO3固体,CaCO3沉淀的溶解度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、碳原子中的质子数为6 |
| B、碳的相对原子质量是12.01g |
| C、碳属于金属元素 |
| D、碳的氧化物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com