
| A. | KNO3 | B. | Ca(OH)2 | C. | BaSO4 | D. | AgCl |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
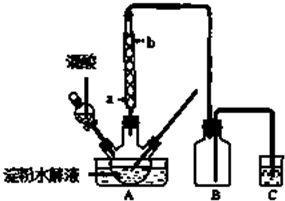
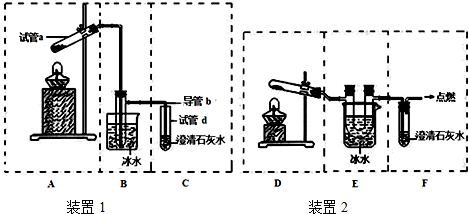
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的钠保存在煤油中 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 新制的氯水保存在棕色玻璃瓶中 | |
| D. | 氢氧化钠溶液保存在具玻璃塞的玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | 砹化氢很稳定 | D. | 砹化银不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤ | C. | ①⑤⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
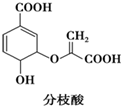
| A. | 分子中含有2种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1 mol分枝酸分子中含2mol-OH(羟基) | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com