
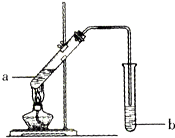
| X | Y |
| Z |
| A. | 气态氢化物的沸点:X<Y<Z | |
| B. | 最高正化合价:Y>X | |
| C. | X、Y、Z的最高价氧化物对应水化物中,Z的酸性最强 | |
| D. | 若X、Y、Z的原子序数之和等于25,则它们都是非金属元素 |
分析 A.非金属性越强,对应氢化物越稳定;
B.Y可能为F,X可能为O;
C.若X为C,Y为N,Z为P,非金属性越强,最高价氧化物对应水化物的酸性越强;
D.设Y的原子序数为x,则X的原子序数为x-1,Z的原子序数为x+8,则x+x-1+x+8=25,解得x=6,可知Y为C,X为B,Z为Si.
解答 解:A.非金属性Y>Z、Y>X,Y的氢化物最稳定,故A错误;
B.Y可能为F,X可能为O,二者均无正价,故B错误;
C.若X为C,Y为N,Z为P,非金属性越强,最高价氧化物对应水化物的酸性越强,则Y的酸性最强,故C错误;
D.设Y的原子序数为x,则X的原子序数为x-1,Z的原子序数为x+8,则x+x-1+x+8=25,解得x=6,可知Y为C,X为B,Z为Si,则均为非金属元素,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
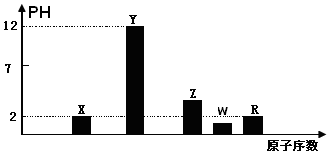
 如图为实验室制备乙酸乙醋的装置.
如图为实验室制备乙酸乙醋的装置.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=1.2 mol/(L•s) | B. | v(NO2)=0.3 mol/(L•min) | ||
| C. | v(N2)=0.6 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2 | B. | Na2S | C. | FeI2 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应发生时不必加热 | |
| B. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应在常温下一定很容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (A)=0.36mol•L-1•s-1 | B. | v (B)=0.55mol•L-1•s-1 | ||
| C. | v (C)=0.40mol•L-1•s-1 | D. | v (D)=0.48mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
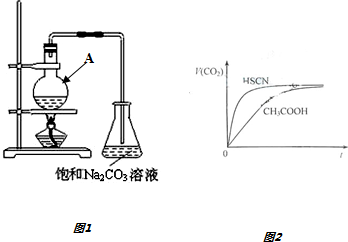
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率 (%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性 (%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com