

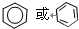 ;
;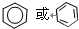 ;
;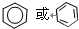 ;
; +2Na
+2Na 
 +H2↑,
+H2↑, +2Na
+2Na 
 +H2↑;
+H2↑;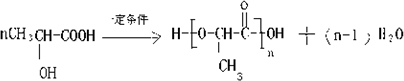 ,
,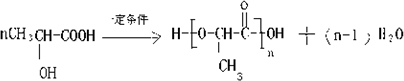 .
.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| 温度/℃ | 30 | 50 | 70 |
| H3BO3物质的量/mol | 1 | 0.8 | 0.4 |

| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 取等物质的量浓度的NaOH溶液A、B、C三等份各100mL,分别向三份溶液中通入不等量的CO2气体,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸的体积之间的关系如图所示.试回答下列问题:
取等物质的量浓度的NaOH溶液A、B、C三等份各100mL,分别向三份溶液中通入不等量的CO2气体,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸的体积之间的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液:K+、Cu2+、Br-、SO42- |
| B、含有0.1mol/LI-的溶液:NH3+、Fe3+、SO42-、Cl- |
| C、含有0.1mol/LHCO3-的溶液:Na+、Al3+、NO3-、OH- |
| D、强酸性溶液:K+、Mg2+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g镁与足量的盐酸反应时失去0.1NA个电子 |
| B、含有0.1NA个CO32-的Na2CO3固体的质量为10.6g |
| C、0.5mol纯硫酸所含有的氧原子数与NA个CO2分子中所含有的氧原子数相等 |
| D、常温常压下,11.2L氧气所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L的C2H6含有原子数等于0.8 NA |
| B、分子数为NA的C2H6气体,其体积一定约为22.4 L |
| C、质量为15 g的C2H6中所含分子数为0.5 NA |
| D、1 mol C2H6分子含有8 NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氯化铁溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+ |
| B、澄清石灰水中加少量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C、用烧碱吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
| D、用O3处理KI中的I-离子:4I-+O3+2H+=2I2+O2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管未用待测盐酸润洗 |
| B、碱式滴定管未用标准碱液润洗 |
| C、滴定过程中锥形瓶中不慎有液体溅出 |
| D、读数时,滴定前仰视,滴定后平视 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、HCO3-、CO32-、Cl- |
| B、NO3-、HCO3-、OH-、K+ |
| C、Al3+、Na+、OH-、SO42- |
| D、H+、Cl-、Na+、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com