
| A. | 10g甲烷中所含有的电子数目为10NA | |
| B. | 常温常压下,4g氦气所含有的质子数目为4NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | Fe-Cu和稀硫酸构成的原电池中,若生成2gH2,则转移的电子数目为2NA |
分析 A、求出甲烷的物质的量,然后根据甲烷中含10个电子来分析;
B、求出氦气的物质的量,然后根据1mol氦气中含2mol质子来分析;
C、标况下,溴为液态;
D、求出氢气的物质的量,然后根据生成1mol氢气时转移2mol电子来分析.
解答 解:A、10g甲烷的物质的量为n=$\frac{10g}{16g/mol}$=$\frac{5}{8}$mol,而甲烷中含10个电子,故$\frac{5}{8}$mol甲烷中含6.25mol电子即6.25NA个,故A错误;
B、4g氦气的物质的量为1mol,而1mol氦气中含2mol质子,即2NA个,故B错误;
C、标况下,溴为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、2g氢气的物质的量为1mol,而生成1mol氢气时转移2mol电子,即2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M、N、Q三种物质的浓度一定相等 | |
| B. | M、N全部变成了Q | |
| C. | 反应混合物各成分的百分组成不再变化 | |
| D. | 反应已经停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等温等压下,aLO2与bLO3混合后得到混合气体的体积为(a+b)L | |
| B. | 配制100mL 0.2mol/LCuSO4溶液,需称取CuSO4•5H2O的质量为5.0 g | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 向某溶液中滴加BaCl2溶液,产生白色沉淀,继续滴加稀盐酸沉淀不溶解,说明原溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的本质是元素化合价发生了变化 | |
| B. | 氧化还原反应的本质是反应中有电子的转移(得失或偏移) | |
| C. | 氧化剂在反应中被氧化 | |
| D. | 氧化反应一定先于还原反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
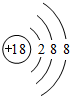 .
.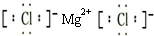 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com