
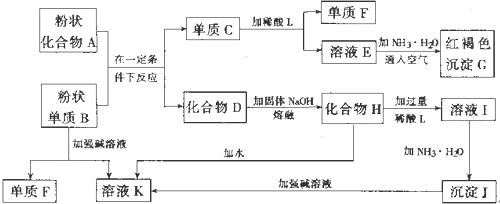
分析 溶液E和氨水、空气反应生成红褐色沉淀,红褐色沉淀G是Fe(OH)3,则E是亚铁盐;单质C和酸L反应生成E和单质F,E是亚铁盐,金属和酸反应生成盐,所以C是Fe、F为H2;沉淀J和强碱反应,则J是Al(OH)3,I和氨水反应生成Al(OH)3,所以I是铝盐;Al(OH)3和强碱反应生成溶液K,Al(OH)3和强碱反应生成偏铝酸盐,所以K是偏铝酸盐,单质B和强碱反应生成偏铝酸盐和氢气,则B是Al,F是H2;化合物A和Al反应生成Fe和化合物D,由铝热反应可知,A是铁的氧化物,D是氧化铝;高温条件下,氧化铝和熔融的氢氧化钠反应生成盐,H为NaAlO2,K是NaAlO2溶液,然后结合化学用语来解答.
解答 解:溶液E和氨水、空气反应生成红褐色沉淀,红褐色沉淀G是Fe(OH)3,则E是亚铁盐;单质C和酸L反应生成E和单质F,E是亚铁盐,金属和酸反应生成盐,所以C是Fe、F为H2;沉淀J和强碱反应,则J是Al(OH)3,I和氨水反应生成Al(OH)3,所以I是铝盐;Al(OH)3和强碱反应生成溶液K,Al(OH)3和强碱反应生成偏铝酸盐,所以K是偏铝酸盐,单质B和强碱反应生成偏铝酸盐和氢气,则B是Al,F是H2;化合物A和Al反应生成Fe和化合物D,由铝热反应可知,A是铁的氧化物,D是氧化铝;高温条件下,氧化铝和熔融的氢氧化钠反应生成盐,H为NaAlO2,K是NaAlO2溶液,
(1)由以上分析可知知,C为Fe,D为Al2O3,F是H2,故答案为:Fe;Al2O3;H2;
(2)由I生成J的离子反应方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)E是亚铁盐,含金属离子为Fe2+,故答案为:Fe2+;
(4)由A与B反应的化学方程式可能为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题考查无机物的推断,为高频考点,把握红褐色沉淀、铝热反应、Fe和Al的化合物性质为解答的关键,侧重分析、推断及应用能力的考查,综合性较强,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钠 | B. | 氯气 | C. | 小苏打 | D. | 明矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③⑤⑥ | C. | ②⑤⑥ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I和Ⅱ的物质的量浓度均为0.001mol•L-1 | |
| B. | 将I稀释10倍,溶液中 c(CH3COOH)、c(OHˉ)均减小 | |
| C. | I和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量 | |
| D. | I和Ⅱ等体积混合后,溶液中离子浓度大小为c(CH3COO-)>c(Na+)>c(H+)>c(OH--) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| B. | 实验室制备硝基苯,将苯和浓硝酸混合后加热即可 | |
| C. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O | |
| D. | 1mol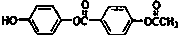 与足量的NaOH溶液加热充分反应,能消耗5molNaOH 与足量的NaOH溶液加热充分反应,能消耗5molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
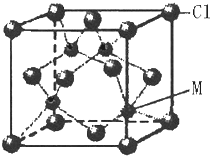 已知W、X、Y、Z、R五种元素是短周期的元素,原子序数依次增大,其中X 的基态原子中成对的电子的对数与单个电子的数目相同,Y 是地壳中含量最多的元素,R的单质是淡黄色固体,不溶于水,能溶于CS2.在短周期中:W的原子半径最小,Z 的原子半径最大.又知M是第四周期的元素,M的最外层只有一个单电子,次外层的轨道上全部填充满了电子.
已知W、X、Y、Z、R五种元素是短周期的元素,原子序数依次增大,其中X 的基态原子中成对的电子的对数与单个电子的数目相同,Y 是地壳中含量最多的元素,R的单质是淡黄色固体,不溶于水,能溶于CS2.在短周期中:W的原子半径最小,Z 的原子半径最大.又知M是第四周期的元素,M的最外层只有一个单电子,次外层的轨道上全部填充满了电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | ||
| C. | CH4 C2H6 C3H8 | D. | C2H2 C2H4 CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径按x、y、z顺序增大 | B. | 阴离子的还原性按x、y、z顺序增强 | ||
| C. | 单质的氧化性按x、y、z顺序增强 | D. | 氢化物的稳定性按x、y、z顺序减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com