
 ��
�� ��
��| ���� ��� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | ||
| I | 387 | 0.40 | 0.16 | 0.16 |
| �� | 387 | 0.80 | a | |
| �� | 207 | 0.40 | 0.18 | 0.18 |
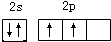
���� ��1��̼ԭ�������4������Ϊ�ڶ����Ӳ��2��s���Ӻ�2��P���ӣ��״��еĹ�����Ϊ�ǻ���Ϊ����ԭ���ţ���ԭ�Ӻ���ԭ���γ�һ�Թ��õ��Ӷԣ�
��2��ͬ����Ԫ��ԭ�Ӵ��ϵ���ʧ����������ǿ���õ�������������������������ۺ����������ǿ���ȽϷǽ�����ǿ����
��3��2CH3OH��g���TCH3OCH3��g��+H2O��g������Ӧ�������������ķ�Ӧ���ﵽƽ��ı�־�����淴Ӧ������ͬ������ֺ������ֲ��䣬��Ӧ�����еġ��������䡱���ж����ݣ�
��4���٢�ʵ���֪��ʼ����ͬ���ﵽƽ��״̬���¶�Խ�������ʵ�����С��ƽ��������У�˵������ӦΪ���ȷ�Ӧ����Ҫ���CH3OH��ƽ��ת���ʣ���Ҫ�ı�����ʹƽ��������У�
��I�������ڵķ�Ӧ����t min�ﵽƽ������CH3OCH3��g�����ʵ���Ϊ0.16mol���������ļ״����ʵ���Ϊ0.16mol����Ϸ�Ӧ����V=$\frac{\frac{��n}{V}}{��t}$����״���ʾ�ķ�Ӧ���ʣ���������ʽ��ʽ������ƽ�ⳣ������ʵ���¶Ȳ���ƽ�ⳣ�����䣬����ƽ�ⳣ����ʽ����aֵ��
��5������ʼʱ������I�г���CH3OH 0.2mol��CH3OCH30.30mol��H2O 0.20mol�������ʱŨ���̣���ƽ�ⳣ���ȽϷ����жϷ�Ӧ���з���
��� �⣺��1��̼ԭ�������4������Ϊ�ڶ����Ӳ��2��s���Ӻ�2��P���ӣ�̼ԭ���������ӵĹ����ʾʽ ���״��еĹ�����Ϊ�ǻ���Ϊ����ԭ���ţ���ԭ�Ӻ���ԭ���γ�һ�Թ��õ��Ӷԣ�����ʽΪ
���״��еĹ�����Ϊ�ǻ���Ϊ����ԭ���ţ���ԭ�Ӻ���ԭ���γ�һ�Թ��õ��Ӷԣ�����ʽΪ ��
��
�ʴ�Ϊ�� ��
�� ��
��
��2��ͬ����Ԫ��ԭ�Ӵ��ϵ���ʧ����������ǿ���õ������������������Էǽ����Խ�ǿ����C������������ۺ����������ǿ���ȽϷǽ�����ǿ�����������̼����ͨ���������Һ�����ɹ����������Ӧ�Ļ�ѧ����ʽΪ��Na2SiO3+CO2+H2O=Na2CO3+H2SiO3����
�ʴ�Ϊ��C��Na2SiO3+CO2+H2O��Na2CO3+H2SiO3����
��3��2CH3OH��g���TCH3OCH3��g��+H2O��g������Ӧ�������������ķ�Ӧ���ﵽƽ��ı�־�����淴Ӧ������ͬ������ֺ������ֲ��䣻
a������֮�ȵ��ڻ�ѧ���̼�����֮��Ϊ����Ӧ����֮�ȣ�CH3OH������������CH3OCH3����������֮��Ϊ2��1��˵��CH3OCH3�����淴Ӧ������ͬ����a��ȷ��
b����Ӧǰ������������䣬��Ӧ������������ѹǿʼ�ձ��ֲ��䣬����˵����Ӧ�ﵽƽ��״̬����b����
c��H2O��g��Ũ�ȱ��ֲ������ƻ��ı�־����c��ȷ��
d����Ӧǰ�������������䣬���ʵ������䣬����ƽ����Է�������ʼ�ձ��ֲ��䣬����˵����Ӧ�ﵽƽ��״̬����d����
�ʴ�Ϊ��ac��
��4���٢�ʵ���֪��ʼ����ͬ���ﵽƽ��״̬���¶�Խ�������ʵ�����С��ƽ��������У�˵������ӦΪ���ȷ�Ӧ����Ҫ���CH3OH��ƽ��ת���ʣ���Ҫ�ı�����ʹƽ��������У�
a����ʱ���߲��ƽ��������У��״�ת��������a��ȷ��
b����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������У���b����
c������CH3OH���൱������ѹǿ��ƽ�ⲻ������c����
d�������¶�ƽ��������У��״�ת��������d��ȷ��
�ʴ�Ϊ��ad��
��I�������ڵķ�Ӧ����t min�ﵽƽ������CH3OCH3��g�����ʵ���Ϊ0.16mol���������ļ״����ʵ���Ϊ0.32mol����Ϸ�Ӧ���ʸ������״���ʾ�ķ�Ӧ����V=$\frac{\frac{��n}{V}}{��t}$=$\frac{\frac{0.32mol}{2L}}{tmin}$=$\frac{0.16}{t}$mol/L•min��
��������ʽ��ʽ������ƽ�ⳣ����
2CH3OH��g���TCH3OCH3��g��+H2O��g��
��ʼ����mol/L�� 0.2 0 0
�仯����mol/L�� 0.16 0.08 0.08
ƽ������mol/L�� 0.04 0.08 0.08
ƽ�ⳣ��K=$\frac{0.08��0.08}{0.0{4}^{2}}$=4
��ʵ���¶Ȳ���ƽ�ⳣ�����䣬����ƽ�ⳣ����ʽ����aֵ
2CH3OH��g���TCH3OCH3��g��+H2O��g��
��ʼ����mol/L�� 0.4 0 0
�仯����mol/L�� a 0.5a 0.5a
ƽ������mol/L�� 0.4-a 0.5a 0.5a
$\frac{0.5a��0.5a}{��0.4-a��^{2}}$=4
a=0.32mol��
�ʴ�Ϊ��$\frac{0.16}{t}$mol/L•min��0.32��
��5������ʼʱ������I�г���CH3OH 0.2mol��CH3OCH30.30mol��H2O 0.20mol�������ʱŨ����Q=$\frac{\frac{0.2}{2}��\frac{0.3}{2}}{��\frac{0.2}{2}��^{2}}$=1.5��K��ƽ�ⳣ���ȽϷ����жϷ�Ӧ���з�����������У�
�ʴ�Ϊ������
���� ���⿼�������ʽṹ���������ڱ��ݱ���ɵ�Ӧ�ã���ѧƽ��Ӱ�����ء�ƽ���־��ƽ�ⳣ���ļ���Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܶȱȿ����� | B�� | ������ˮ | ||
| C�� | ��һ����ɫ | D�� | �е����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H1����H2����H3 | B�� | ��H2����H3����H1 | C�� | ��H1=��H2=��H3 | D�� | ��H1����H3����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+HCO3-NO3-ClO- | B�� | Na+SO32-NH4+Ba2+ | ||
| C�� | Ba2+ HS-Cl-SO42- | D�� | AlO2-CO32-Cl-Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaCl2 MgCl2 Na2O | B�� | H2O Na2O ? CO2 | ||
| C�� | CaCl2 ? NaOH H2SO4 | D�� | NH4Cl H2O CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������ | NH4+��Mg2+��K+��Al3+ |
| ������ | HCO3-��MnO4-��SO42-��Cl- |
| A�� | �϶�û�� Mg2+��HCO3-��Cl-��MnO4- | |
| B�� | һ������ K+����c��K+��=2mol/L | |
| C�� | ����Һ������KAl��SO4��2��NH4Al��SO4��2�Ļ����Һ | |
| D�� | ��������ʵ��ۣ�������Һ���ɡ����գ��п��ܵõ��������������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2-�һ����� | B�� | 3��4-�������� | C�� | 1��5-������ | D�� | 3��4-�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���������� | �Ȼ� | �ǻ� | ̼̼˫�� | ���� |
| ��������Ŀ | 1 | 1 | 1 | ���� |
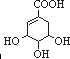 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
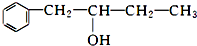
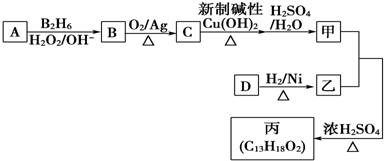
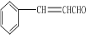 ��
��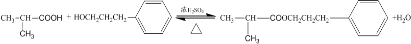 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com