
| 2 |
| 3 |
c(N
| ||
| c(OH-) |
| 2 |
| 3 |
| m |
| V |
| 10-3×10-3 |
| 0.1 |
c(N
| ||
| c(OH-) |


科目:高中化学 来源: 题型:
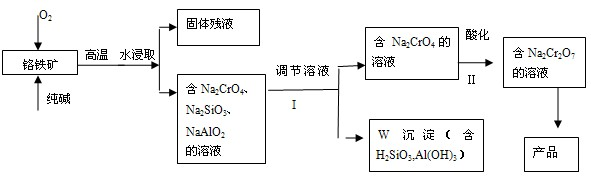
| c(Cr2O72-) |
| c2(CrO42-)?c2(H+) |
| c(Cr2O72-) |
| c2(CrO42-)?c2(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
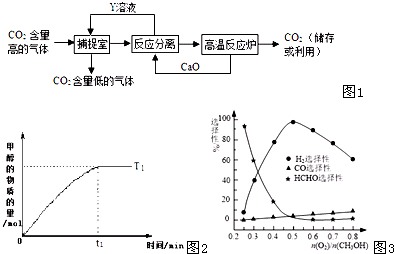
 (2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.c(N
| ||
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
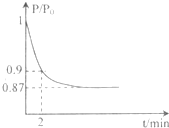 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.| 1 |
| 2 |
| 高温、高压 |
| 催化剂 |
| P |
| P0 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.| 催化剂 |
| 催化剂 |
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com