
已知:Ksp[Fe(OH)3]=1.1×10-36(mol·L-1)4,Ksp[Fe(OH)2]=1.64×10-14(mol·L-1)3。????
解析:解此题时,可先从Fe3+沉淀完全时,其浓度为1.0×10-5 mol·L-1,根据Ksp[Fe(OH)3]可以算出溶液中OH-的浓度,求出此时的pH,再通过Ksp[Fe(OH)2]求出Fe2+为0.050 mol·L-1时OH-的最大浓度,换算出pH,满足要求的pH范围即可求出。?
答案:设Fe3+沉淀完全时,[Fe3+]为1.0×10-5 mol·L-1,则Fe3+完全沉淀时所需[OH-]为:[OH-]=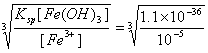 mol·L-1=4.8×10-11 mol·L-1?
mol·L-1=4.8×10-11 mol·L-1?
pH=14-pOH=14-10.3=3.7?
Fe2+开始沉淀时所需[OH-]为:[OH-]= mol·L-1=5.7×10-7 mol·L-1?
mol·L-1=5.7×10-7 mol·L-1?
pH=14-pOH=14-6.2=7.8?
因此,溶液的pH控制在3.7~7.8之间,可使Fe3+沉淀完全,而Fe2+不沉淀。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
 工业上常用铁质容器盛装冷浓硫酸.某兴趣小组的同学发现:将一定量的铁钉与浓硫酸加热时,观察到铁钉完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.10mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
工业上常用铁质容器盛装冷浓硫酸.某兴趣小组的同学发现:将一定量的铁钉与浓硫酸加热时,观察到铁钉完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.10mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 溶液紫红色褪去 |
含有Fe2+ 含有Fe2+ |
| 步骤②: 另取少量所得溶液,滴加KI和淀粉溶液 另取少量所得溶液,滴加KI和淀粉溶液 |
溶液变为蓝色 溶液变为蓝色 |
含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变;试管中收集到气体 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变;试管中收集到气体 |
含有两种或以上气体 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 预期现象和结论 |
| 步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管I、II备用 | 溶液有颜色 溶液有颜色 |
| 步骤二:往试管I中, 滴加少量的淀粉KI溶液 滴加少量的淀粉KI溶液 |
若溶液变蓝色,则原溶液中含有Fe3+ 若溶液变蓝色,则原溶液中含有Fe3+ |
| 步骤三: 往试管II滴加到少量的KMnO4溶液 往试管II滴加到少量的KMnO4溶液 |
若溶液褪色(浅红),则原溶液中含有Fe2+,结合步骤二溶液变蓝,则假设3正确 若溶液褪色(浅红),则原溶液中含有Fe2+,结合步骤二溶液变蓝,则假设3正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
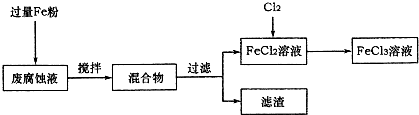
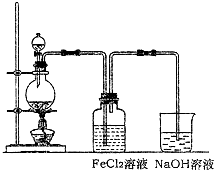
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com