
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;iv、其他。请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m | 2 | ________ |
VSEPR理想模型 | ________ | 正四面体 |
价层电子对之间的理想键角 | ________ | 109°28′ |
(2)请用VSEPR模型解释CO2为直线型分子的原因_________________________________;
(3)H2O分子的立体构型为:___________________,请你预测水分子中∠H-O-H的大小范围并解释原因______________________________________________________________;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:_____________________________, SO2Cl2分子中∠Cl-S-Cl________________(选填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
(5)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
分子或 离子 | PbCl2 | XeF4 | SnCl62- | PF3Cl2 | HgCl42- | ClO4-- |
空间 构型 | _____ | _____ | _____ | _____ | _____ | _____ |
【答案】4 直线形 180° CO2属AX2E0,n+m=2,故为直线形 折线形(或V形) 水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′。根据Ⅲ-i,应有∠H-O-H<109°28′ 四面体 > 角形 平面正方 正八面体 三角双锥 四面体 正四面体
【解析】
(1)当n+m=4时,VSEPR模型为四面体形,当n+m=2时,VSEPR模型为直线形;
(2) 根据 CO2属AX2E0,n+m=2,故为直线形;
(3)根据H2O属AX2E2,n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对来判断分子的立体构型;水分子属AX2E2,n+m=4,VSEPR模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i来判断键角;
(4)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对来判断分子的立体构型;X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
(5)根据价层电子对互斥理论确定亚硫酸根离子空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() (a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数。
(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数。
(1)当n+m=4时,VSEPR模型为四面体形,其键角是109°28′,当n+m=2时,VSEPR模型为直线形,其键角是180°;
(2) 根据 CO2属AX2E0,n+m=2,故为直线形;
(3)H2O属AX2E2,n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对,所以分子的构型为V形;
水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i,应有∠H-O-H<109°28′,故答案为:V形;∠H-O-H<109°28′;
(4)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对,所以分子构型为四面体形,F原子的得电子能力大于氯原子,因为X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强,所以SO2Cl2分子中∠Cl-S-Cl>SO2F2分子中∠F-S-F;
(5)PbCl2中中心原子Pb原子的孤对电子对数是![]() =1,即Pb原子是sp2杂化,所以是V型结构或角形;
=1,即Pb原子是sp2杂化,所以是V型结构或角形;
XeF4分子中价层电子对个数=3+![]() (5-3×1)=4,且含有一个孤电子对,所以为平面正方结构;
(5-3×1)=4,且含有一个孤电子对,所以为平面正方结构;
SnCl62-分子中价层电子对个数=6+0=6,所以是正八面体;
PF3Cl2分子中价层电子对个数=5+0=5,所以三角双锥;
HgCl42-分子中价层电子对个数=4+0=4,所以是四面体;
高氯酸根离子中价层电子对个数=4+![]() (7+1-4×2)=4,且不含孤电子对,为正四面体结构;
(7+1-4×2)=4,且不含孤电子对,为正四面体结构;
故答案为:
分子或 离子 | PbCl2 | XeF4 | SnCl62- | PF3Cl2 | HgCl42- | ClO4- |
空间 构型 | V型 | 平面正方 | 正八面体 | 三角双锥 | 四面体 | 正四面体 |


科目:高中化学 来源: 题型:
【题目】对已达化学平衡的反应:2X(g)+Y(g)![]() 2Z(g),减小压强后,对反应产生的影响是
2Z(g),减小压强后,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动
D.逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,有顺反异构体的是( )
A. 1,2﹣二氯乙烯ClCH=CHCl
B. 1,1﹣二氯乙烯 Cl2C=CH2
C. 丙烯 CH3﹣CH=CH2
D. 苯乙烯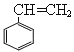
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:

(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键
B. 乳酸有一对对映异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 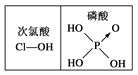
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物说法不正确的是( )
A. 等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同
B. 四苯基乙烯(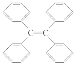 )中所有碳原子一定处于同一平面
)中所有碳原子一定处于同一平面
C. 1 mol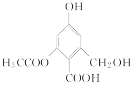 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3 mol、4 mol、1 mol
分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3 mol、4 mol、1 mol
D. 1molβ紫罗兰酮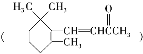 与1molBr2发生加成反应可得3种产物
与1molBr2发生加成反应可得3种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气;
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能;
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能; ![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同);
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是 ( )
A.含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) H=-114.6kJ/mol
B.已知热化学方程式: SO2(g)+![]() O2(g)
O2(g) ![]() SO3(g) H=-98.32kJ/mol,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量为196.64kJ
SO3(g) H=-98.32kJ/mol,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量为196.64kJ
C.已知2H2(g)+O2(g) =2H2O(g)H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol
D.用稀氨水与稀盐酸进行中和热的测定实验,计算得到的中和热的H偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的铁、铝合金与300mL 2mol/L硝酸完全反应生成3.36LNO(标况)和三价铁盐、铝盐等,再向反应后的溶液中加入3mol/L的NaOH溶液,使铝、铁元素完全沉淀下来,则所加NaOH溶液的体积是( )
A. 450mL B. 150mL C. 200mL D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com