
| 方法一 | 石灰-石膏法:用石灰浆吸收SO2转化为石膏 |
| 方法二 | 碱发:用NaOH溶液吸收SO2转化为Na2SO3 |
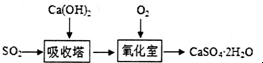 .
. .该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为
.该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为
| 1mol |
| 2mol |


科目:高中化学 来源: 题型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| CH4 | C3H6 | C5H8 | C2H6 | C4H8 | C3H8 | C5H10 | C7H12 |
| A、1、4、7对应的烃互为同系物,2、5、8对应的烃互为同系物 |
| B、第6种烃与等物质的量的溴加成,所得产物有2种,则该烃的结构有4种(不考虑顺反异构) |
| C、第8种烃一定能使酸性高锰酸钾溶液褪色 |
| D、1、4、7对应的烃中碳的质量分数逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| B、用惰性电极电解足量的CuCl2溶液时,当有0.2 mol电子转移时阳极会析出6.4g铜 |
| C、用25 mL碱式滴定管量取15.00mL 0.1000 mol?L-1酸性高锰酸钾溶液 |
| D、将水加热,Kw增大,pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 440℃ |
| A、金刚石与石墨互为同素异形体 |
| B、11.5 g金属钠的物质的量为0.5 mol |
| C、44 g CO2在标准状况下的体积为22.4 L |
| D、Na2CO3的摩尔质量为106 g |
查看答案和解析>>
科目:高中化学 来源: 题型:

| OH-加热 |
 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com