
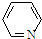 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N在周期表的位置是同一周期从左到右,N 的原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N在周期表的位置是同一周期从左到右,N 的原子半径更小,原子核对外层电子的吸引力更强. 分析 (1)氨气在催化剂条件下与氧气反应生成一氧化氮和水;
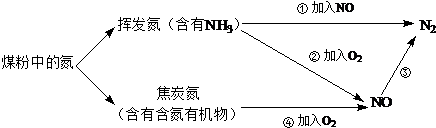
(2)由图表可知,氮由+2价变成0价,应加还原剂;
(3)N的电负极强,所以N原子吸引电子能力更强,C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强;.
解答 解:(1)氨气在催化剂条件下与氧气反应生成一氧化氮和水,为重要的工业反应,反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)氮由+2价变成0价,应加还原剂,选项中可以作还原剂的为CO和氨气,
故答案为:bd;
(3)N的电负极强,所以N原子吸引电子能力更强,由于C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强,故答案为:强;C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
点评 本题考查较为综合,涉及氨气的制备、性质以及氮氧化物的性质,侧重于基础知识的考查,题目较为简单,注意相关基础知识的学习与积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 | |
| B. | 负极的电极反应式为CH4+10OH--8e-═CO${\;}_{3}^{2-}$+7H2O | |
| C. | 随着反应的进行,电解质溶液的pH保持不变 | |
| D. | 甲烷燃料电池的能量利用率比甲烷燃烧的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 激光法蒸发石墨得C60 | B. | 丁达尔效应 | ||
| C. | 紫色石蕊试液通过活性炭变成无色 | D. | 用铂丝蘸取NaCl溶液进行焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com