

 .
. .
. -COOH),其反应类型是c
-COOH),其反应类型是c分析 (1)根据结构简式可确定分子式;
(2)A中含有碳碳双键,可与溴发生加成反应;
(3)A中含有羧基,具有酸性,可与NaOH发生中和反应;
(4)计算出A的物质的量,可计算生成气体的体积;
(5)根据官能团的转化可判断反应类型.
解答 解:(1)由结构简式可知A的分子式为C7H10O5,故答案为:C7H10O5;
(2)A环上的C═C键具有和乙烯类似的性质,可以和Br2发生加成反应,反应的方程式为 ,
,
故答案为: ;
;
(3)A环上的-OH是醇羟基,不能和NaOH、NaHCO3等发生反应,A中含有羧基,具有酸性,可与NaOH发生中和反应,反应的方程式为 ,
,
故答案为: ;
;
(4)A和NaHCO3发生的反应可以表示为: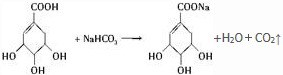 ,生成二氧化碳的体积为$\frac{17.4g}{174g/mol}$×22.4L/mol=2.24L,
,生成二氧化碳的体积为$\frac{17.4g}{174g/mol}$×22.4L/mol=2.24L,
故答案为:2.24L;
(5)A和浓硫酸混合加热发生消去反应,形成含C=C的不饱和化合物.其原理类似CH3CH2OH和浓硫酸共热生成CH2=CH2,故答案为:c.
点评 本题考查有机物的结构与性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团及性质的关系,体会结构决定物质的性质,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 最外层只有1个电子的原子一定是金属元素的原子 | |
| B. | 最外层只有2个电子的原子一定是金属元素的原子 | |
| C. | 原子核外各电子层电子数相等的原子一定是金属元素的原子 | |
| D. | 最外层电子数最多的原子最容易获得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑥ | C. | ②③⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=10 b=9.2 | B. | a<10 b>9.2 | C. | a>10 b=9.2 | D. | a>10 b<9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com