
(10分)氢化钙(CaH2,其中H元素的化合价为 –1价)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。
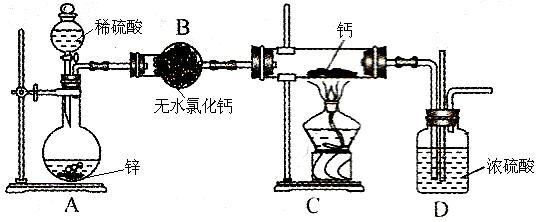
(1)氢化钙与水反应的化学方程式为:__________________。
该反应中氧化产物与还原产物的物质的量之比为:__________________。
(2)利用图示实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,_____________________(请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)装置B的作用是:_____________________________________;为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是:_____________。
(10分,每空2分)
(1)CaH2+2H2O=Ca(OH)2+H2↑ 1︰1
(2)②①④③
(3)除去氢气中的水蒸气;无水硫酸铜
【解析】
试题分析:(1)根据题中信息:氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,可写出反应方程式CaH2+2H2O=Ca(OH)2+H2↑;CaH2中H是-1价,Ca(OH)2中H是+1价,是氧化产物;H2中H是0价,是还原产物,氧化产物与还原产物的物质的量之比等于化学计量数之比,是1:1。(2)有气体参加加热或燃烧的反应需要首先验纯,实验完毕后先熄火、冷却,在停止气体生成,防止倒吸发生爆炸。(3)H2在发生加热反应之前需要干燥,一般用无水氯化钙;检验是否干燥用无水硫酸铜,因为无水硫酸铜遇水变蓝色现象很明显。
考点:化学实验
点评:分析好题中的信息,本题测重基本实验操作能力考查。


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省鱼台一中高一上学期期末模拟化学试卷(带解析) 题型:实验题
(10分)氢化钙(CaH2,其中H元素的化合价为 –1价)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。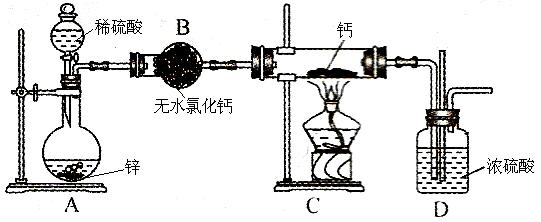
(1)氢化钙与水反应的化学方程式为:__________________。
该反应中氧化产物与还原产物的物质的量之比为:__________________。
(2)利用图示实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,_____________________(请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)装置B的作用是:_____________________________________;为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是:_____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省高三高考模拟理综化学试卷(解析版) 题型:实验题
氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置:
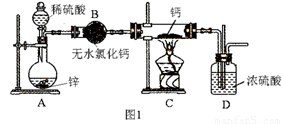
(1)装置B的作用是 ;装置D的作用是 ;
(2)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是: 。
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度(杂质中不含钙元素。请完善下列实验步骤:
①样品称量;②加入________溶液(填化学式),搅拌、过滤;③________(填操作名称);④_______ (填操作名称); ⑤称量碳酸钙。
(5)乙同学利用注射器测量氢化钙和水反应氢气体积的方法,测定上述实验中得到的氢化钙的纯度。他称取46 mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定)。试通过计算求样品中氢化钙的纯度: 。
(6)请你再设计一种氢化钙纯度的测定方法: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com