
下列有关实验操作和结论均正确的是
选项 | 操作 | 结论 |
A | 配制Fe(NO3)2溶液时加入适量的硝酸 | 抑制Fe2+水解 |
B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
C | 往溶液中滴加NaOH溶液,将湿润红色石蕊试纸置于试管口试纸不变蓝 | 原溶液中无NH4+ |
D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
A. A B. B C. C D. D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:推断题
双安妥明可用于降低血液中的胆固醇,其结构简式为:

该物质的合成线路如下:
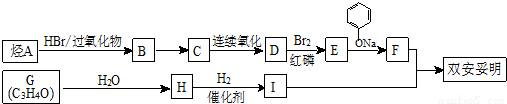
已知:I. 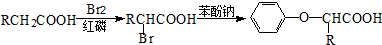
II. RCH═CH2 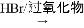 RCH2CH2Br
RCH2CH2Br
III.同温同压下A的密度是H2密度的28倍,且支链有一个甲基;G能发生银镜反应,且1molG能与2molH2发生加成反应。
(1)双安妥明的分子式为___________________。
(2)A的结构简式为___________________。
(3)反应B→C的反应条件是______________,G→H的反应类型是________________。
(4)反应“F+I→双安妥明”的化学方程式为___________________。
(5)符合下列3个条件的F的同分异构体有____________种。条件:①与FeCl3溶液显色;②苯环上只有两个取代基;③1mol该物质最多可与3molNaOH反应。
(6)参照上述合成路线,请设计由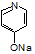 (
(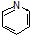 与苯环性质相似)与
与苯环性质相似)与 苯合成
苯合成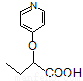 的路线______________。
的路线______________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三第三次联考理综化学试卷(解析版) 题型:简答题
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为___________。已知N2O与CO2分子具有相似的结构,试画出N2O的结构式_______。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。
已知:2NO2(g) N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2(g)+2O2(g)=2NO2(g) △H =+ckJ·mol-1;(a、b、c均大于0)。
写出气态腁在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式___________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如p(NO2)=p总×x(NO2))。写出反应2NO2(g) N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式________(用p总、各气体物质的量分数x表示)。
N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式________(用p总、各气体物质的量分数x表示)。
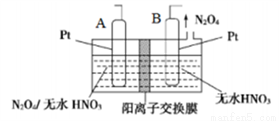
(4)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的____极,电解池中生成N2O5的电极反应式为_____________。
(5)可用氨水吸收NO2、O2生成硝酸铵,写出该反应的离子方程式_____________。
已知25℃时NH3·H2O的电离常数Kb=2×10-5,向500ml0.1mol·L-1硝酸铵溶液中通入标准状况下至少____ml氨气,使溶液呈中性(溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳、信阳等六市高三第一次联考理综化学试卷(解析版) 题型:选择题
下列有关有机物的说法中
①结构片段为……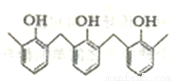 ……的高聚物,其单体是甲醛和苯酚
……的高聚物,其单体是甲醛和苯酚
②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应: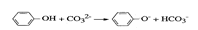
⑤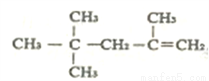 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有 个。
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源:2017届安徽省淮南市高三第一次模拟考试理综化学试卷(解析版) 题型:简答题
从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填字母序号)。
a. Fe b. FeO c. Fe3O4 d. Fe2O3
(2) 现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。 整个过程与温度密切相关, 当温度低于 570℃时,反应Fe3O4(s)+4 CO(g) 3Fe(s)+4 CO2(g),阻碍循环反应的进行。
3Fe(s)+4 CO2(g),阻碍循环反应的进行。
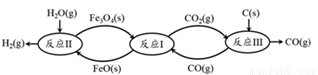
① 已知:Fe3O4(s) + CO(g)  3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g) Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
C(s)+CO2 2CO(g) ΔH3 =+172.4 kJ·mol-1 。
2CO(g) ΔH3 =+172.4 kJ·mol-1 。
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________。
② 下图表示其他条件一定时, Fe3O4(s)和 CO(g)反应达平衡时 CO(g)的体积百分含量随温度的变化关系。

i. 当温度低于570℃时,温度降低CO的转化率____(填“增大”、“减小”或“不变”),理由是______。
ii. 当温度高于570℃时,随温度升高,反应 Fe3O4(s) + CO(g) 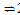 3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
(3)① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应 ii 的离子方程式是_______________。
② 如今基于普鲁士蓝合成原理可检测食品中 CN-,方案如下:
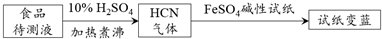
若试纸变蓝则证明食品中含有 CN-,请解释检测时试纸变蓝的原因_________。
(4)已知25℃时,Kap[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配置100mL 5mol/LFeCl3溶液,为使配置过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸_________mL(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省常州市高三第一次模拟考试化学试卷(解析版) 题型:填空题
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为_________ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
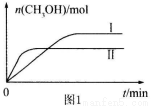
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g) CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。

(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省常州市高三第一次模拟考试化学试卷(解析版) 题型:选择题
在探究SO2水溶液成分和性质的实验中,下列根据实验现象得出的结论正确的是
A. 向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性
B. 向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42-
C. 将SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性
D. 向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性
查看答案和解析>>
科目:高中化学 来源:2017届山东省临沂市高三上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便。下列说法不正确的是 ( )
A. 对于C2H4(g)+H2O(g)=C2H5OH(g)在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数Kp=
B. 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)=2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。若此时A、B和C均增加1mol,平衡正向移动
C. 一恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)=2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动
D. 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A. K+、AlO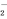 、Cl-、SO
、Cl-、SO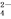
B. H+、Ba2+、Cl-、NO
C. Ca2+、Fe2+、NO 、HCO
、HCO
D. Na+、Cl-、CO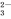 、SO
、SO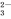
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com